Le bisulfite de magnésium (Mg(HSO3)2) est un composé chimique composé de magnésium, de soufre et d’oxygène. Il est couramment utilisé dans l’industrie alimentaire comme conservateur et antioxydant pour prévenir la détérioration et la décoloration.
| Nom UICPA | Hydrogénosulfite de magnésium |
| Formule moléculaire | Mg(HSO3)2 |
| Numero CAS | 13774-25-9 |
| Synonymes | Bisulfite de magnésium ; Hydrogénosulfite de magnésium ; Bisulfite de magnésie |
| InChI | InChI=1S/2H2O3S.Mg/c2 1-4(2)3;/h2 (H2,1,2,3);/q;;+2/p-2 |
Propriétés du bisulfite de magnésium
Formule de bisulfite de magnésium
La formule chimique du bisulfite de magnésium est Mg(HSO3)2. La formule représente le nombre d’atomes de chaque élément présent dans une molécule du composé. La formule du bisulfite de magnésium est essentielle pour déterminer les réactions chimiques que peut subir le composé.
Bisulfite De Magnésium Masse molaire
Mg(HSO3)2 a une masse molaire de 186,45 g/mol. Cette valeur représente le poids d’une mole du composé en grammes. La masse molaire d’un composé est essentielle pour déterminer la quantité d’une substance nécessaire pour effectuer des réactions chimiques. La masse molaire de Mg(HSO3)2 est calculée en additionnant les poids atomiques de chaque élément du composé. Le magnésium a un poids atomique de 24,305 g/mol, le soufre a un poids atomique de 32,06 g/mol et l’oxygène a un poids atomique de 15,999 g/mol.
Point d’ébullition du bisulfite de magnésium
Le Mg(HSO3)2 n’a pas de point d’ébullition car il se décompose lorsqu’il est chauffé. Cependant, il peut libérer du dioxyde de soufre et du trioxyde de soufre lorsqu’il est chauffé en présence d’un acide. Ces gaz peuvent irriter le système respiratoire et avoir de graves effets sur la santé lorsqu’ils sont inhalés. Il est donc essentiel de manipuler le Mg(HSO3)2 avec précaution et de suivre les précautions de sécurité lors de son utilisation dans des processus industriels.
Bisulfite de magnésium Point de fusion
Le Mg(HSO3)2 a un point de fusion de 110 °C. Cette valeur représente la température à laquelle le composé passe de l’état solide à l’état liquide. Le Mg(HSO3)2 a un point de fusion bas, ce qui le rend facile à fondre et à utiliser dans divers processus industriels. Cependant, il peut se décomposer à haute température, entraînant le dégagement de gaz nocifs.
Densité du bisulfite de magnésium g/mL
Mg(HSO3)2 a une densité de 2,35 g/mL. Cette valeur représente la quantité de masse en grammes présente dans un millilitre du composé. La densité du Mg(HSO3)2 est supérieure à celle de l’eau, qui a une densité de 1 g/mL. La haute densité du Mg(HSO3)2 le rend utile dans diverses applications, notamment comme conservateur et antioxydant dans l’industrie alimentaire.
Bisulfite De Magnésium Poids moléculaire
Mg(HSO3)2 a un poids moléculaire de 186,45 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes du composé. Le poids moléculaire de Mg(HSO3)2 est essentiel pour déterminer la quantité de composé nécessaire pour effectuer des réactions chimiques.
Structure du bisulfite de magnésium
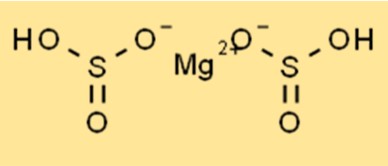
Mg(HSO3)2 a une structure cristalline et appartient au système cristallin orthorhombique. Le composé est constitué de cations magnésium (Mg2+) et d’anions bisulfite (HSO3-). Les anions bisulfite sont de forme tétraédrique, tandis que les cations magnésium sont de forme octaédrique. La structure cristalline du Mg(HSO3)2 le rend stable et lui permet d’être utilisé dans diverses applications, notamment comme conservateur alimentaire.
Solubilité du bisulfite de magnésium
Le Mg(HSO3)2 est hautement soluble dans l’eau, avec une solubilité d’environ 64 g/100 mL à 20°C. Il est également soluble dans le méthanol, mais insoluble dans la plupart des solvants organiques. La solubilité du Mg(HSO3)2 peut varier en fonction de facteurs tels que la température et le pH.
| Apparence | poudre blanche |
| Gravité spécifique | 2,35 g/cm3 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 186,45 g/mole |
| Densité | 2,35 g/ml |
| Point de fusion | 110 °C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau et l’éthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 1,91 |
| pH | 4,5 – 5,5 |
Sécurité et dangers du bisulfite de magnésium
Le Mg(HSO3)2 peut présenter plusieurs risques pour la santé et la sécurité s’il n’est pas manipulé avec soin. Il peut libérer des gaz de dioxyde de soufre et de trioxyde de soufre lorsqu’il est chauffé ou exposé à des conditions acides. Ces gaz peuvent provoquer une irritation respiratoire, de la toux et un essoufflement en cas d’inhalation. Le Mg(HSO3)2 peut également provoquer une irritation cutanée et des rougeurs au contact. Il est essentiel de porter des vêtements et des équipements de protection, tels que des gants et des lunettes, lors de la manipulation du Mg(HSO3)2. De plus, il doit être stocké dans un endroit frais et sec, à l’écart des sources de chaleur et des matériaux incompatibles. Des procédures de manipulation et de stockage appropriées peuvent minimiser le risque de dangers associés au Mg(HSO3)2.
| Symboles de danger | Xi : Irritant |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Portez des vêtements et des équipements de protection. Tenir à l’écart de la chaleur et des matières incompatibles. |
| Numéros d’identification de l’ONU | ONU 2693 |
| Code SH | 2831.10.00 |
| Classe de danger | 8 – Substances corrosives |
| Groupe d’emballage | III |
| Toxicité | Peut provoquer une irritation de la peau et des yeux. Nocif en cas d’inhalation ou d’ingestion. Peut provoquer une irritation des voies respiratoires et de la toux. |
Méthodes de synthèse du bisulfite de magnésium
On peut synthétiser du Mg(HSO3)2 par diverses méthodes, notamment :
- Réaction de l’hydroxyde de magnésium avec le dioxyde de soufre : Dans la réaction de l’hydroxyde de magnésium avec le dioxyde de soufre, les deux substances réagissent pour produire du Mg(HSO3)2 et de l’eau.
- Réaction directe de l’oxyde de magnésium avec le dioxyde de soufre : À haute température, le dioxyde de soufre gazeux réagit directement avec l’oxyde de magnésium pour produire du Mg(HSO3)2 et de l’oxygène.
- Réaction du sulfate de magnésium avec le dioxyde de soufre : En présence d’un agent réducteur, le sulfate de magnésium réagit avec le dioxyde de soufre gazeux, entraînant la production de Mg(HSO3)2.
- Carbonate de magnésium avec du dioxyde de soufre : La réaction entre le carbonate de magnésium et le dioxyde de soufre gazeux produit du Mg(HSO3)2 et du dioxyde de carbone.
- Réaction de l’oxyde de magnésium avec l’acide sulfurique et le dioxyde de soufre : lors de la réaction de l’oxyde de magnésium avec de l’acide sulfurique et du dioxyde de soufre gazeux, la réaction produit du Mg(HSO3)2 et de l’eau.
Utilisations du bisulfite de magnésium
Le Mg(HSO3)2 a diverses utilisations dans différentes industries. Voici quelques applications courantes :
- Industrie alimentaire et des boissons : Utilisé comme conservateur dans l’industrie alimentaire et des boissons pour prévenir l’oxydation et la croissance microbienne. Il est couramment utilisé dans les jus de fruits, le vin et la bière.
- Traitement de l’eau : Utilisé dans le traitement de l’eau comme agent réducteur pour éliminer le chlore et d’autres agents oxydants. Il est efficace pour contrôler l’odeur et le goût de l’eau.
- Industrie textile : Utilisé comme agent de blanchiment dans l’industrie textile. Il est efficace pour éliminer les taches et améliorer la couleur des tissus.
- Industrie pharmaceutique : Utilisé comme agent réducteur dans l’industrie pharmaceutique. Il est utilisé pour convertir les groupes nitro en groupes amino dans diverses molécules médicamenteuses.
- Industrie des pâtes et papiers : Utilisé dans l’industrie des pâtes et papiers comme agent de blanchiment. Il est efficace pour éliminer la lignine de la pâte de bois et améliorer la brillance du papier.
- Agriculture : Utilisé en agriculture comme amendement du sol pour corriger les carences en magnésium du sol. Il est également utilisé comme engrais foliaire pour améliorer la croissance et le rendement des plantes.
Des questions:
Q : Quelles sont les propriétés thermodynamiques du bisulfite de magnésium ?
R : Les propriétés thermodynamiques du Mg(HSO3)2 incluent son point d’ébullition de 250 °C, son point de fusion de 70 à 72 °C et sa densité de 1,84 g/mL.
Q : Quelle est la formule chimique du bisulfite de magnésium ?
R : La formule chimique du bisulfite de magnésium est Mg(HSO3)2.
Q : Où puis-je acheter du bisulfite de magnésium ?
R : Mg(HSO3)2 peut être acheté auprès de divers fournisseurs et distributeurs de produits chimiques. Il est couramment disponible en grandes et en petites quantités. Certaines plateformes en ligne telles que Sigma Aldrich, Fisher Scientific et VWR International proposent également du Mg(HSO3)2 à l’achat. Il est important de s’assurer que le fournisseur est réputé et que le produit répond aux normes requises pour l’application prévue.
