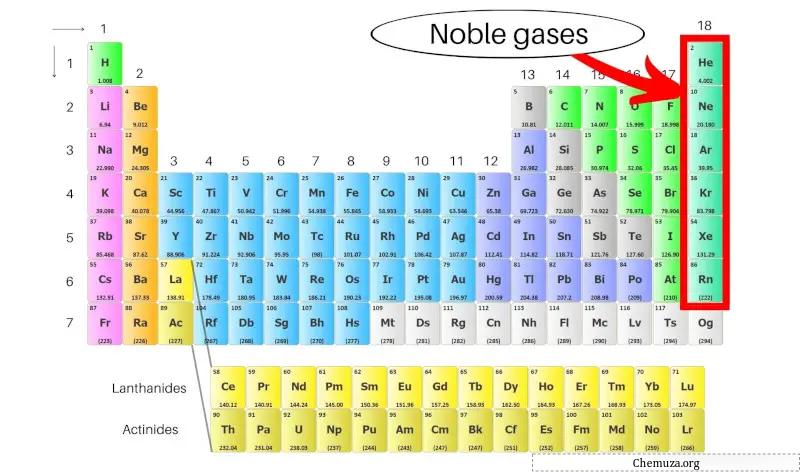
Les gaz rares, également appelés gaz inertes, sont un groupe d’éléments situés dans la colonne la plus à droite du tableau périodique . Ils comprennent l’hélium (He), le néon (Ne), l’argon (Ar), le krypton (Kr), le xénon (Xe) et le radon (Rn).
Ces éléments sont connus pour leur faible réactivité en raison de leurs couches électroniques complètes les plus externes, ce qui les rend stables et non réactifs avec d’autres éléments. [1]
Explorons davantage les gaz rares du tableau périodique.
Que sont les gaz rares ?
Les gaz rares sont des éléments du groupe 18 qui se caractérisent par leur très faible réactivité avec d’autres substances, ce qui signifie qu’ils ne forment généralement pas de composés avec d’autres éléments.
Ils sont également appelés gaz inertes car ils sont très stables et ne réagissent pas facilement avec d’autres substances. Les gaz rares comprennent l’hélium, le néon, l’argon, le krypton, le xénon et le radon.
Les gaz rares se trouvent en petites quantités dans l’atmosphère terrestre et sont utilisés dans diverses applications, telles que l’éclairage, le soudage et la cryogénie. [2]
Pourquoi les gaz rares sont-ils inertes ?
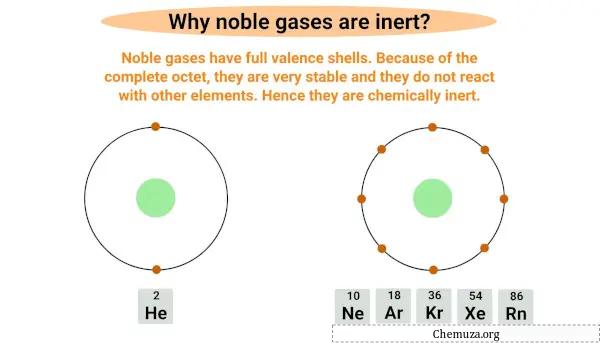
Les gaz rares sont inertes ou non réactifs car ils possèdent une couche électronique complète la plus externe, également connue sous le nom de couche de valence .
La couche de valence est la couche d’électrons la plus externe qui entoure un atome et contient ses électrons de valence , qui sont les électrons impliqués dans les réactions chimiques.
Les gaz rares ont un octet complet, ce qui signifie qu’ils ont une couche de valence complète avec huit électrons, à l’exception de l’hélium qui n’a que deux électrons dans sa couche la plus externe.
Avoir un octet complet les rend très stables et peu susceptibles de réagir avec d’autres éléments.
Dans les réactions chimiques, les éléments ont tendance à gagner ou à perdre des électrons afin d’obtenir un octet complet dans leur couche de valence, mais comme les gaz rares ont déjà une couche de valence complète, ils n’ont pas besoin de gagner ou de perdre des électrons.
Cette configuration stable des gaz rares est due à leur configuration électronique.
La couche d’électrons la plus externe de ces éléments est pleine et ils n’ont donc pas besoin de gagner ou de perdre des électrons.
Cela signifie qu’ils sont très peu réactifs et n’ont pas tendance à former de liaisons chimiques avec d’autres éléments.
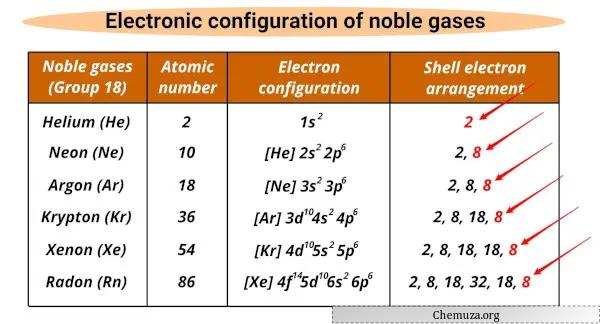
Liste des gaz rares et leurs configurations électroniques
Les gaz rares et leurs configurations électroniques sont indiqués ci-dessous.
Qu’est-ce qui est commun à tous les gaz rares ?
Les gaz rares partagent certaines propriétés communes .
Ils possèdent tous le même nombre d’électrons de valence (soit 8), sauf l’hélium qui en possède 2.
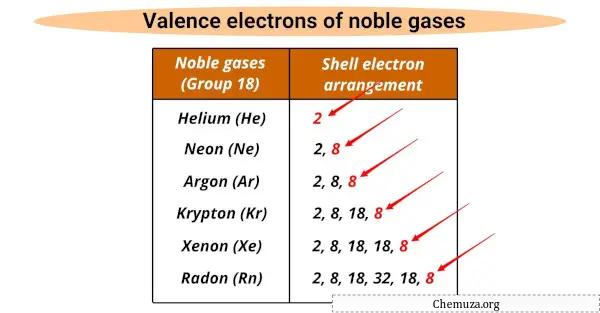
Les électrons de valence sont les électrons les plus externes d’un atome qui participent aux réactions chimiques, et les gaz rares ont une couche de valence complète qui les rend non réactifs.
De plus, les gaz rares sont des gaz incolores que nous ne pouvons pas voir, et ils sont également inodores , ce qui signifie qu’ils n’ont pas d’odeur. [3]
Enfin, ils existent naturellement sous forme de gaz monoatomiques , ce qui signifie qu’ils ne possèdent qu’un seul atome sous leur forme élémentaire.
Contrairement à la plupart des autres éléments qui ont tendance à former des molécules en se liant à d’autres atomes, les gaz rares n’ont pas besoin de se lier à d’autres atomes car ils ont une coque à valence complète, ce qui les rend très stables et non réactifs.
Résumé
Les gaz rares sont un groupe d’éléments que l’on trouve dans la colonne la plus à droite du tableau périodique, notamment l’hélium, le néon, l’argon, le krypton, le xénon et le radon.
Ils se caractérisent par leur faible réactivité due à leurs couches électroniques entièrement externes. Les gaz rares sont inertes ou non réactifs car ils ont une enveloppe à valence complète, ce qui les rend très stables et peu susceptibles de réagir avec d’autres éléments.
Les gaz rares partagent des propriétés communes, notamment le même nombre d’électrons de valence (8 sauf l’hélium qui en a 2), un gaz incolore et inodore, et existent naturellement sous forme de gaz monoatomiques.
Ils sont utilisés dans diverses applications telles que l’éclairage, le soudage et la cryogénie, ainsi que comme liquides de refroidissement dans les réacteurs nucléaires et comme charges pour les ampoules à incandescence.
