L’hypochlorite de potassium (KClO) est un composé chimique couramment utilisé comme désinfectant et agent de blanchiment. Il dégage une forte odeur et peut être dangereux s’il n’est pas manipulé correctement.
| Nom UICPA | Hypochlorite de potassium |
| Formule moléculaire | KClO |
| Numero CAS | 7778-66-7 |
| Synonymes | Acide hypochloreux, sel de potassium ; Oxychlorure de potassium ; Chlorate de potassium(I) |
| InChI | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Propriétés de l’hypochlorite de potassium
Formule d’hypochlorite de potassium
La formule chimique de l’hypochlorite de potassium est KClO. Il se compose d’un ion potassium, d’un atome de chlore et d’un atome d’oxygène. L’hypochlorite de potassium est un solide blanc à température ambiante et dégage une forte odeur de chlore. Il est couramment utilisé comme désinfectant et agent de blanchiment dans diverses industries.
Hypochlorite De Potassium Masse molaire
La masse molaire de KClO est de 90,55 g/mol. C’est la somme des masses atomiques des éléments constitutifs potassium, chlore et oxygène. La masse molaire est un paramètre important utilisé en stœchiométrie et autres calculs chimiques.
Point d’ébullition de l’hypochlorite de potassium
KClO se décompose avant d’atteindre son point d’ébullition. Son point d’ébullition n’est donc pas bien défini. Lorsqu’il est chauffé, il se décompose en chlorure de potassium et en oxygène gazeux. La décomposition du KClO est une réaction exothermique et peut être dangereuse si elle n’est pas manipulée correctement.
Hypochlorite de potassium Point de fusion
Le point de fusion de KClO est de 100 à 102°C. C’est un solide blanc à température ambiante et fond lorsqu’il est chauffé. Le point de fusion est une propriété physique importante d’une substance et est utilisé pour identifier et caractériser la substance.
Densité de l’hypochlorite de potassium g/ml
La densité de KClO est de 2,35 g/mL. Cela signifie qu’un millilitre de KClO pèse 2,35 grammes. La densité est une mesure de la masse par unité de volume d’une substance et constitue un paramètre important dans les calculs chimiques.
Hypochlorite De Potassium Poids moléculaire
Le poids moléculaire de KClO est de 90,55 g/mol. C’est la somme des poids atomiques des éléments constitutifs d’une molécule de KClO. Le poids moléculaire est utilisé dans les calculs chimiques tels que la détermination de la masse molaire et la stœchiométrie.
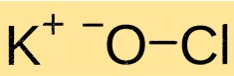
Structure de l’hypochlorite de potassium
KClO a une structure cristalline. Il est constitué de cations K+ et d’anions ClO- maintenus ensemble par des liaisons ioniques. La structure de KClO est similaire à celle d’autres composés ioniques et est déterminée par la charge et la taille des ions constituants.
Solubilité de l’hypochlorite de potassium
KClO est très soluble dans l’eau. Il forme une solution de cations K+ et d’anions ClO- lorsqu’il est dissous dans l’eau. La solubilité du KClO dans l’eau est affectée par la température et le pH. Des températures plus élevées et des valeurs de pH plus faibles augmentent la solubilité du KClO dans l’eau.
| Apparence | Solide blanc |
| Gravité spécifique | 2,35 |
| Couleur | Blanc |
| Odeur | Forte odeur de chlore |
| Masse molaire | 90,55 g/mole |
| Densité | 2,35 g/ml |
| Point de fusion | 100-102°C |
| Point d’ébullition | Se décompose avant le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcalin (pH 11-13) |
Sécurité et dangers de l’hypochlorite de potassium
KClO peut être dangereux s’il n’est pas manipulé correctement. C’est un agent oxydant puissant qui peut réagir avec des matières organiques pour produire des composés dangereux. Le KClO est également un puissant irritant pour la peau, les yeux et le système respiratoire. Le contact direct avec la peau peut provoquer des brûlures et des irritations. L’inhalation de vapeurs de KClO peut provoquer de la toux, une respiration sifflante et un essoufflement. Le composé doit être manipulé dans un endroit bien ventilé, avec un équipement de protection individuelle approprié tel que des gants, des lunettes et un respirateur. En cas d’exposition accidentelle, des soins médicaux immédiats doivent être recherchés.
| Symboles de danger | Oxydant |
| Description de la sécurité | Porter des gants et une protection des yeux/du visage. Garder éloigné des matériaux combustibles. Eviter le contact avec la peau et les yeux. |
| Numéros d’identification de l’ONU | UN1748 |
| Code SH | 2828.90.10 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Peut être nocif en cas d’ingestion. Provoque de graves brûlures de la peau et des lésions oculaires. Peut provoquer une irritation respiratoire. |
Méthodes de synthèse de l’hypochlorite de potassium
Diverses méthodes existent pour synthétiser l’hypochlorite de potassium.
Une méthode courante consiste à faire réagir du chlore gazeux avec une solution d’ hydroxyde de potassium . La réaction produit du KClO et du chlorure de potassium comme sous-produits :
Cl2 + 2KOH → KCl + KClO + H2O
Une autre méthode implique la réaction de l’hypochlorite de calcium avec le chlorure de potassium . Cette réaction produit du KClO et du chlorure de calcium comme sous-produits :
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Pour synthétiser le KClO, on peut réagir avec l’acide hypochloreux avec de l’hydroxyde de potassium .
2 KOH + HOCl → KClO + KCl + H2O
Pour produire du KClO, on peut utiliser l’électrolyse pour faire passer un courant électrique à travers une solution d’eau et de chlorure de potassium. La réaction produit du KClO, de l’hydrogène gazeux et de l’hydroxyde de potassium comme sous-produits :
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Il faut stocker le KClO synthétisé dans un endroit frais et sec, à l’abri de la lumière directe du soleil et de la chaleur.
Utilisations de l’hypochlorite de potassium
KClO a diverses utilisations dans diverses industries et applications. Voici quelques-unes de ses utilisations courantes :
- Traitement de l’eau : Utilisé comme désinfectant dans les usines de traitement de l’eau pour tuer les bactéries et autres organismes nuisibles.
- Agent de blanchiment : Utilisé comme agent de blanchiment dans l’industrie textile pour blanchir les tissus.
- Désinfectant : Utilisé comme désinfectant dans l’industrie alimentaire pour désinfecter les surfaces et les équipements en contact avec les aliments.
- Entretien de la piscine : Utilisé comme désinfectant et algicide dans les piscines pour garder l’eau propre et claire.
- Stérilisation : Utilisé pour la stérilisation en milieu médical et en laboratoire afin de désinfecter l’équipement et les surfaces.
- Désodorisant : Utilisé comme désodorisant dans les stations d’épuration pour neutraliser les odeurs désagréables.
- Industrie des pâtes et papiers : Utilisé dans l’industrie des pâtes et papiers comme agent de blanchiment pour les produits en papier.
- Agriculture : Utilisé en agriculture comme pesticide et fongicide pour protéger les cultures contre les ravageurs et les maladies.
- Désinfectant : Utilisé comme désinfectant dans les produits d’entretien ménager pour tuer les germes et les bactéries.
- Industrie pétrolière et gazière : Utilisé dans l’industrie pétrolière et gazière pour traiter les puits de pétrole et les pipelines afin de contrôler les bactéries et de prévenir la corrosion.
Des questions:
Q : Qu’est-ce que l’hypochlorite de potassium ?
R : L’hypochlorite de potassium est un composé chimique de formule KClO, qui est couramment utilisé comme désinfectant, agent de blanchiment et produit chimique de traitement de l’eau.
Q : Quel est le pH d’une solution 0,42 M de KClO ? [Ka(HClO) = 4,0 × 10–8]
R : Le pH d’une solution 0,42 M de KClO peut être calculé en utilisant la valeur Ka de son acide conjugué, HClO. Le pH est d’environ 12,69.
Q : Qu’est-ce que l’hypochlorite de sodium et l’hydroxyde de potassium ?
R : L’hypochlorite de sodium est un composé chimique de formule NaClO, couramment utilisé comme agent de blanchiment et désinfectant. L’hydroxyde de potassium est un composé chimique de formule KOH, couramment utilisé dans la production de savon et comme réactif de laboratoire.
Q : Quel est le pH d’une solution aqueuse 0,116 M de KClO ?
R : Le pH d’une solution aqueuse 0,116 M de KClO peut être calculé en utilisant la valeur Kb de sa base conjuguée, ClO-. Le pH est d’environ 11,31.
Q : Quel est le pH d’une solution aqueuse 0,191 M de KClO ?
R : Le pH d’une solution aqueuse 0,191 M de KClO peut être calculé en utilisant la valeur Kb de sa base conjuguée, ClO-. Le pH est d’environ 11,92.
Q : Le KClO est-il soluble ?
R : Oui, KClO est soluble dans l’eau et forme une solution alcaline.
Q : Puis-je mélanger de l’hypochlorite de sodium et de l’hypochlorite de potassium ?
R : Le mélange d’hypochlorite de sodium et de KClO n’est pas recommandé car cela peut entraîner une réaction chimique produisant de la chaleur, des gaz et des sous-produits potentiellement dangereux.
