Le bromure de cuivre (CuBr2) est un composé formé de cuivre et de brome. Il présente une couleur bleu-vert, souvent utilisée en synthèse organique et comme catalyseur acide de Lewis.
| Nom UICPA | Bromure de cuivre (II) |
| Formule moléculaire | CuBr2 |
| Numero CAS | 7789-45-9 |
| Synonymes | Bromure cuivrique, dibromure de cuivre |
| InChI | InChI=1S/Br2.Cu |
Propriétés du bromure de cuivre
Formule de bromure de cuivre
La formule du bromure cuivrique est CuBr2. Il représente un composé formé d’un atome de cuivre et de deux atomes de brome. Cette combinaison donne une substance cristalline bleu-vert, couramment utilisée dans diverses réactions chimiques.
Bromure De Cuivre Masse molaire
La masse molaire du bromure cuivrique est d’environ 223,36 grammes par mole. Cette valeur est obtenue en additionnant les masses atomiques d’un atome de cuivre (Cu) et de deux atomes de brome (Br) présents dans la formule CuBr2.
Point d’ébullition du bromure de cuivre
Le bromure cuivrique présente un point d’ébullition d’environ 1 294 degrés Celsius (environ 2 361 degrés Fahrenheit). Cette température indique le point auquel la substance passe de l’état liquide à l’état gazeux sous pression atmosphérique standard.
Point de fusion du bromure de cuivre
Le point de fusion du bromure cuivrique est d’environ 498 degrés Celsius (environ 928 degrés Fahrenheit). Cette température représente le point auquel la substance solide se transforme en état liquide lorsqu’elle est chauffée.
Densité du bromure de cuivre g/mL
La densité du bromure cuivrique est d’environ 4,71 grammes par millilitre (g/mL) à température ambiante et à pression atmosphérique standard. Cette valeur révèle la quantité de masse présente par unité de volume de la substance.
Bromure De Cuivre Poids moléculaire
Le bromure cuivrique a un poids moléculaire d’environ 223,36 grammes par mole. Cette valeur est cruciale pour divers calculs chimiques et sert de référence pour la quantité de substance présente dans un échantillon donné.
Structure du bromure de cuivre
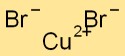
Le bromure cuivrique a une structure de réseau cristallin dans laquelle les atomes de cuivre sont entourés d’atomes de brome et vice versa. Cet arrangement forme un motif stable et ordonné, contribuant aux propriétés physiques du composé.
Solubilité du bromure de cuivre
Le bromure cuivrique a une solubilité limitée dans l’eau. Il est plus soluble dans les solvants organiques. La solubilité dépend de facteurs tels que la température et la nature du solvant utilisé. Comprendre sa solubilité est vital pour diverses applications en chimie et dans l’industrie.
| Apparence | Cristaux bleu-vert |
| Gravité spécifique | Pas disponible |
| Couleur | Bleu vert |
| Odeur | Inodore |
| Masse molaire | 223,36 g/mole |
| Densité | 4,71 g/ml |
| Point de fusion | 498°C (928°F) |
| Point d’ébullition | 1 294 °C (2 361 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Solubilité limitée |
| Solubilité | Soluble dans les solvants organiques tels que l’éthanol, l’éther et le benzène |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du bromure de cuivre
Le bromure cuivrique pose certaines considérations en matière de sécurité et de dangers. Il est essentiel de manipuler ce composé avec prudence en raison de sa toxicité potentielle et de ses propriétés irritantes. Le contact direct avec la peau ou les yeux peut provoquer une irritation et un inconfort. L’inhalation de ses poussières ou de ses fumées peut irriter les voies respiratoires. Par conséquent, un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lorsque vous travaillez avec du bromure cuivrique. De plus, il doit être conservé à l’écart des substances incompatibles pour éviter des réactions potentielles. En cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin. Le respect des consignes de sécurité est crucial pour garantir une manipulation et une utilisation sûres du bromure cuivrique.
| Symboles de danger | Irritant, Corrosif |
| Description de la sécurité | Manipulez avec prudence. Évitez tout contact direct avec la peau et les yeux. Utiliser un équipement de protection approprié. |
| Numéros d’identification de l’ONU | Pas disponible |
| Code SH | Pas disponible |
| Classe de danger | Irritant |
| Groupe d’emballage | Pas disponible |
| Toxicité | Peut provoquer une irritation de la peau et des yeux. L’inhalation de poussières ou de fumées peut irriter les voies respiratoires. |
Méthodes de synthèse du bromure de cuivre
Il existe plusieurs méthodes pour synthétiser le bromure cuivrique (CuBr2). Une approche courante implique la combinaison directe de cuivre métallique ou d’oxyde de cuivre avec de l’acide bromhydrique . Dans cette méthode, nous ajoutons du cuivre à l’acide, et celui-ci subit une réaction chimique, entraînant la formation de bromure cuivrique et la libération d’hydrogène gazeux.
Une autre méthode est la réaction entre le carbonate de cuivre ou l’hydroxyde de cuivre avec l’acide bromhydrique. Le carbonate ou l’hydroxyde réagit avec l’acide pour produire du bromure cuivrique, de l’eau et du dioxyde de carbone.
De plus, pour synthétiser le bromure cuivrique, on peut utiliser une réaction de double déplacement. Cette méthode implique la réaction entre un sel de cuivre soluble, tel que le sulfate de cuivre, et un sel de bromure soluble, comme le bromure de sodium. La réaction conduit à la formation de bromure cuivrique et d’un sel soluble de l’autre métal ou métalloïde présent dans la réaction.
De plus, pour synthétiser le bromure cuivrique, nous pouvons utiliser des méthodes électrochimiques. Ces méthodes impliquent l’utilisation d’une cellule électrochimique avec des électrodes de cuivre et une source d’ions bromure. Lorsque nous appliquons un courant, du bromure cuivrique se forme sur une électrode, tandis que du brome gazeux se libère sur l’autre électrode.
Le choix de la méthode de synthèse dépend de facteurs tels que la disponibilité des réactifs, la pureté souhaitée et l’ampleur de la réaction. Une manipulation appropriée et des précautions de sécurité doivent être observées pendant toutes les procédures de synthèse.
Utilisations du bromure de cuivre
Le bromure de cuivre (CuBr2) trouve des applications polyvalentes dans diverses industries en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations notables :
- Synthèse organique : Le bromure cuivrique sert de catalyseur dans de nombreuses réactions organiques, comme le couplage d’Ullmann et la réaction de Wurtz-Fittig, permettant la formation de liaisons carbone-carbone et carbone-hétéroatome.
- Photographie : Il est utilisé dans les processus photographiques pour sensibiliser les émulsions et améliorer la sensibilité des films et des plaques, facilitant ainsi la capture d’images de haute qualité.
- Galvanoplastie : Le bromure de cuivre est utilisé dans les processus de galvanoplastie pour déposer des couches de cuivre sur les surfaces, offrant ainsi une résistance à la corrosion et des finitions décoratives.
- Industrie des semi-conducteurs : Dans le secteur de l’électronique, il est utilisé dans la synthèse de nanocristaux à base de bromure cuivrique, qui ont des applications en optoélectronique et en photonique.
- Colorant de flamme : Le bromure de cuivre est utilisé dans les pièces pyrotechniques et les feux d’artifice pour produire une couleur de flamme verte, ajoutant un attrait visuel aux affichages.
- Médecine : Bien que limitée, elle a été explorée pour des applications thérapeutiques potentielles en raison de ses propriétés antibactériennes.
- Technologie laser : Les lasers au bromure de cuivre sont utilisés dans la recherche scientifique, les études de fluorescence induite par laser et pour générer des impulsions laser à haute énergie.
- Analyse chimique : Il est utilisé en chimie analytique pour des analyses qualitatives et quantitatives.
- Réactions de bromation : Le bromure cuivrique agit comme un agent de bromation, facilitant l’ajout de brome aux composés organiques.
- Lithographie : Dans les procédés lithographiques, les composés à base de bromure de cuivre ont été étudiés pour être utilisés dans les techniques de micro et nanofabrication.
Les diverses applications du bromure cuivrique démontrent son importance dans divers domaines, ce qui en fait un composé précieux dans les efforts industriels et scientifiques.
Des questions:
Q : Quelle est la masse molaire du bromure de cuivre(II) ?
R : La masse molaire du bromure cuivrique (II) est d’environ 223,36 g/mol.
Q : Quelle est la formule du bromure de cuivre (II) ?
R : La formule du bromure cuivrique (II) est CuBr2.
Q : Le bromure de cuivre (II) est-il soluble dans l’eau ?
R : Le bromure cuivrique (II) a une solubilité limitée dans l’eau.
Q : À quoi sert le bromure de cuivre (II) ?
R : Le bromure de cuivre (II) est utilisé comme catalyseur dans la synthèse organique, en photographie, en galvanoplastie et dans l’industrie des semi-conducteurs.
Q : Le zinc et le bromure de cuivre constituent-ils un remplacement unique ?
R : Oui, le zinc et le bromure cuivrique (II) subissent une seule réaction de remplacement, produisant du bromure de zinc et du Cu métallique.
Q : Une réaction se produit-elle lorsque des solutions aqueuses d’acétate de baryum et de bromure de cuivre(II) sont combinées ?
R : Oui, une réaction se produit, entraînant la formation de bromure de baryum et d’acétate de cuivre (II).
Q : Quels ions, le cas échéant, se forment lorsque du bromure de cuivre (II) est ajouté à l’eau ?
R : Lorsque le bromure cuivrique (II) est ajouté à l’eau, il se dissocie en ions Cu^2+ et en ions bromure (Br^-).
Q : CuBr2 forme-t-il une liaison ionique ?
R : Oui, CuBr2 forme une liaison ionique entre les ions cuivre et brome.
Q : CuBr2 forme-t-il une liaison covalente ?
R : Non, CuBr2 ne forme pas de liaison covalente.
Q : Le CuBr2 est-il soluble dans l’eau ?
R : CuBr2 a une solubilité limitée dans l’eau.
Q : Qu’est-ce que CuBr2 ?
R : CuBr2 est la formule chimique du bromure cuivrique (II), un composé cristallin bleu-vert.
Q : Le CuBr2 est-il soluble ou insoluble ?
R : CuBr2 est peu soluble dans l’eau.
Q : Quel est le pourcentage massique de cuivre dans CuBr2 ?
R : Le pourcentage massique de cuivre dans CuBr2 est d’environ 47,5 %.
