Le chlorate de potassium (KClO3) est un composé chimique composé de potassium, de chlore et d’oxygène. Il est couramment utilisé dans la fabrication d’allumettes, d’explosifs et de feux d’artifice en raison de ses propriétés oxydantes.
| Nom UICPA | Chlorure de potassium |
| Formule moléculaire | KClO3 |
| Numero CAS | 3811-04-9 |
| Synonymes | Kaliumchlorat, Chlorkalic, Chlorate de potassium, Perchlorate de potassium, UN 1485, Chlorate de potassium, Kalium perchloricum |
| InChI | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
Propriétés du chlorate de potassium
Formule de chlorate de potassium
Le chlorate de potassium a une formule chimique KClO3, ce qui indique qu’il est constitué d’un atome de potassium, d’un atome de chlore et de trois atomes d’oxygène. C’est un composé ionique qui se forme lorsque les ions K+ et ClO3- se combinent via une liaison ionique. Le composé est très réactif en raison de la présence d’oxygène, ce qui lui confère de fortes propriétés oxydantes.
Chlorate De Potassium Masse molaire
La masse molaire de KClO3 est de 122,55 g/mol. Il s’agit de la somme des masses atomiques des éléments individuels qui composent le composé, à savoir le potassium, le chlore et l’oxygène. La masse molaire est un paramètre important en chimie car elle est utilisée pour calculer la masse d’une substance nécessaire pour produire une certaine quantité de produit lors d’une réaction chimique.
Point d’ébullition du chlorate de potassium
KClO3 n’a pas de point d’ébullition bien défini puisqu’il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il se décompose en chlorure de potassium et en oxygène gazeux. Par conséquent, KClO3 subit une réaction de décomposition thermique plutôt qu’un point d’ébullition.
Chlorate de potassium Point de fusion
Le point de fusion de KClO3 est de 356 °C (673 °F). A cette température, le composé solide fond et se transforme en liquide. Le point de fusion est une propriété essentielle d’un composé car il influence le comportement physique de la substance, notamment sa solubilité et sa densité.
Densité du chlorate de potassium g/mL
La densité de KClO3 est de 2,32 g/mL à température ambiante. Cela signifie qu’un volume spécifique du composé a une certaine masse, ce qui est utile pour déterminer la masse d’une substance requise pour une réaction chimique particulière. La densité du KClO3 affecte également sa solubilité dans l’eau, car les composés de densité plus élevée ont tendance à être moins solubles dans l’eau.
Chlorate De Potassium Poids moléculaire
Le poids moléculaire de KClO3 est de 122,55 g/mol. C’est la somme des poids atomiques de ses atomes constitutifs, à savoir le potassium, le chlore et l’oxygène. Le poids moléculaire est un paramètre essentiel en stœchiométrie car il est utilisé pour calculer les quantités de réactifs et de produits dans une réaction chimique.
Structure du chlorate de potassium
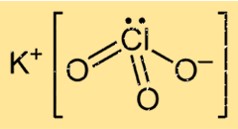
KClO3 a une structure cristalline sous sa forme solide, constituée d’atomes de potassium, de chlore et d’oxygène disposés selon un motif spécifique. Le composé forme une structure de réseau cristallin cubique à faces centrées, dans laquelle chaque ion potassium est entouré de six atomes d’oxygène et chaque ion oxygène est entouré de quatre atomes de potassium et de deux atomes de chlore.
Solubilité du chlorate de potassium
KClO3 est modérément soluble dans l’eau, avec une solubilité de 7 g/100 ml d’eau à température ambiante. La solubilité du composé augmente avec la température, car les molécules d’eau ont plus d’énergie cinétique et peuvent dissoudre une plus grande partie du composé. KClO3 est également soluble dans d’autres solvants polaires tels que l’éthanol et l’acétone.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,32 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 122,55 g/mole |
| Densité | 2,32 g/cm³ |
| Point de fusion | 356 °C (673 °F) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 7 g/100 mL à 20 °C |
| Solubilité | Soluble dans l’éthanol et l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH | Le pH d’une solution 0,1 M est d’environ 6,5 à 7,5 |
Sécurité et dangers du chlorate de potassium
Le KClO3 est une substance hautement réactive et potentiellement dangereuse, elle doit donc être manipulée avec une extrême prudence. Il peut provoquer de graves irritations de la peau et des yeux et peut être toxique en cas d’ingestion ou d’inhalation. Lorsqu’il est chauffé, il peut subir une réaction violente et même exploser. Le KClO3 peut également réagir fortement avec d’autres produits chimiques, tels que l’acide sulfurique et les composés organiques, et produire des gaz toxiques comme le chlore et le dioxyde de chlorate. Il est important de suivre les protocoles de sécurité appropriés lorsque vous travaillez avec du KClO3, notamment en portant un équipement de protection et en travaillant dans un endroit bien ventilé.
| Symboles de danger | O, Xi, N |
| Description de la sécurité | Évitez tout contact avec des matériaux combustibles. Toxique en cas d’ingestion. Provoque de graves brûlures de la peau et des lésions oculaires. |
| Numéros d’identification de l’ONU | UN1485 |
| Code SH | 2829.90.10 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du chlorate de potassium
Il existe plusieurs méthodes pour synthétiser le KClO3.
Une méthode implique la réaction entre le chlorure de potassium et l’eau de Javel. Cette méthode consiste à ajouter une solution d’eau de Javel à une solution de chlorure de potassium et à remuer le mélange. Pour donner du KClO3, filtrer et laver le précipité obtenu.
Une autre méthode implique l’électrolyse d’une solution contenant du chlorure de potassium , de l’eau et une source d’oxygène. Une cellule électrolytique, un appareil spécialisé, effectue ce processus en séparant les ions potassium et chlorure et en produisant de l’oxygène gazeux. L’oxygène réagit avec les ions potassium pour former du KClO3.
Une troisième méthode implique la réaction entre l’hydroxyde de potassium et le chlore gazeux, qui donne du KClO3 avec du chlorure de potassium et de l’eau. Cette méthode nécessite un contrôle minutieux de la température et de la concentration des réactifs pour garantir des rendements optimaux.
Utilisations du chlorate de potassium
KClO3 a un large éventail d’utilisations dans diverses industries, notamment :
- Produits pyrotechniques : Couramment utilisé comme agent oxydant dans les feux d’artifice et autres dispositifs pyrotechniques.
- Allumettes : Utilisées dans les têtes d’allumettes de sécurité, qui s’enflamment lorsqu’elles sont frappées contre une surface rugueuse.
- Engrais : Utilisé comme source de potassium pour les engrais végétaux.
- Agent de blanchiment : utilisé comme agent de blanchiment pour les textiles, le papier et d’autres matériaux.
- Réactif de laboratoire : Également utilisé comme réactif de laboratoire pour diverses réactions chimiques.
- Applications médicales : Utilisé en médecine pour traiter certains types d’affections cutanées, comme l’eczéma.
- Explosifs : ingrédient commun dans certains types d’explosifs, tels que les détonateurs et la dynamite.
- Oxydant : Utilisé comme agent oxydant dans la production de certains produits chimiques, tels que les perchlorates.
Des questions:
Q : Combien de grammes de chlorure de potassium sont produits si 25 g de chlorate de potassium se décomposent ?
R : Lorsque 25 g de KClO3 se décomposent, ils produisent 13,47 g de chlorure de potassium.
Q : Comment fabriquer du chlorate de potassium ?
R : Le KClO3 peut être fabriqué en faisant réagir du chlorure de potassium avec de l’eau de Javel, par électrolyse d’une solution contenant du chlorure de potassium ou en faisant réagir de l’hydroxyde de potassium avec du chlore gazeux.
Q : Combien de moles d’oxygène sont produites lorsque 2 moles de chlorate de potassium (kclo3) se décomposent ?
R : Lorsque 2 moles de KClO3 se décomposent, cela produit 3 moles d’oxygène gazeux.
Q : Une solution 0,70 m contient 3,0 g de chlorate de potassium (kclo3). Quel est le volume de la solution ?
R : Le volume de la solution 0,70 m contenant 3,0 g de KClO3 est de 51,4 mL.
Q : Le chlorate de potassium est-il volatil ?
R : KClO3 n’est pas considéré comme une substance volatile, car son point de fusion et d’ébullition est relativement élevé.
Q : Quelle quantité de kcl est produite si vous décomposez 2,50 g de kclo3 ?
R : Lorsque 2,50 g de KClO3 se décomposent, ils produisent 1,35 g de chlorure de potassium.
Q : Le kclo3 est-il soluble dans l’eau ?
R : Oui, KClO3 est hautement soluble dans l’eau, avec une solubilité de 7 g/100 mL à température ambiante.
Q : Combien de grammes d’oxygène peuvent être produits à partir de la décomposition de 100 g de kclo3 ?
R : Lorsque 100 g de KClO3 se décomposent, ils produisent 45,02 g d’oxygène gazeux.
