Le tétrachloroéthylène (C2Cl4) est un liquide incolore et ininflammable couramment utilisé dans le nettoyage à sec. Il peut provoquer des problèmes de santé tels que des étourdissements, des maux de tête et des lésions hépatiques en cas d’ingestion ou d’inhalation excessive.
| Nom UICPA | Tétrachloroéthène |
| Formule moléculaire | C2Cl4 |
| Numero CAS | 127-18-4 |
| Synonymes | Perchloroéthylène, PCE, tétrachloroéthène, dimère de tétrachlorure de carbone, 1,1,2,2-tétrachloroéthylène |
| InChI | InChI=1S/C2Cl4/c3-1(4)2(5)6 |
Propriétés du tétrachloroéthylène
Formule de tétrachloroéthylène
Le tétrachloroéthylène, également connu sous le nom de perchloroéthylène ou PCE, a une formule chimique C2Cl4. Cela signifie que chaque molécule de tétrachloroéthylène est composée de deux atomes de carbone et de quatre atomes de chlore. La formule est importante car elle nous aide à comprendre la structure moléculaire et les propriétés du tétrachloroéthylène.
Tétrachloroéthylène Masse molaire
La masse molaire de C2Cl4 est de 165,83 g/mol. Cela signifie qu’une mole de C2Cl4, qui équivaut à 6,022 x 10^23 molécules, pèse 165,83 grammes. La masse molaire est importante dans les calculs chimiques et peut aider à déterminer la quantité de C2Cl4 nécessaire pour une réaction spécifique.
Point d’ébullition du tétrachloroéthylène
Le point d’ébullition du C2Cl4 est de 121,1°C (250°F). Cela signifie qu’à une température de 121,1°C, le C2Cl4 passera d’un liquide à un gaz. Le point d’ébullition est une propriété importante car elle affecte la façon dont le C2Cl4 se comporte dans différents environnements.
Tétrachloroéthylène Point de fusion
Le point de fusion du C2Cl4 est de -22,94°C (-9,31°F). Cela signifie qu’à une température inférieure à -22,94°C, le C2Cl4 passera d’un solide à un liquide. Le point de fusion est important pour déterminer l’état physique du C2Cl4 à différentes températures.
Tétrachloroéthylène Densité g/mL
La densité du C2Cl4 est de 1,62 g/mL à température ambiante. Cela signifie que le C2Cl4 est plus dense que l’eau, qui a une densité de 1 g/mL. La densité est importante pour comprendre les propriétés physiques du C2Cl4 et son comportement dans différents environnements.
Tétrachloroéthylène Poids moléculaire
Le poids moléculaire du C2Cl4 est de 165,83 g/mol. Cela signifie que le poids d’une molécule de C2Cl4 est de 165,83 unités de masse atomique. Le poids moléculaire est important dans les calculs chimiques et peut aider à déterminer la quantité de C2Cl4 nécessaire pour une réaction spécifique.
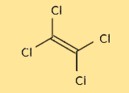
Structure du tétrachloroéthylène
La structure du C2Cl4 est constituée de deux atomes de carbone et de quatre atomes de chlore disposés en forme tétraédrique. Les atomes de carbone sont reliés par une double liaison, tandis que chaque atome de chlore est lié à l’un des atomes de carbone. La structure est importante pour comprendre les propriétés chimiques et physiques du C2Cl4.
Solubilité du tétrachloroéthylène
Le C2Cl4 est insoluble dans l’eau, mais il est soluble dans les solvants organiques tels que l’alcool et l’éther. Cela signifie que le C2Cl4 ne se dissoudra pas dans l’eau, mais qu’il peut se dissoudre dans d’autres substances. La solubilité est importante pour comprendre le comportement du C2Cl4 dans différents environnements, comme dans les milieux industriels ou en laboratoire.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,62 à 20°C |
| Couleur | Incolore |
| Odeur | Odeur douce et éthérée |
| Masse molaire | 165,83 g/mole |
| Densité | 1,62 g/mL à 20°C |
| Point de fusion | -22,94°C |
| Point d’ébullition | 121,1 °C |
| Point d’éclair | 55°C |
| Solubilité dans l’eau | 0,015 g/100 mL à 25°C |
| Solubilité | Soluble dans l’alcool et l’éther |
| Pression de vapeur | 10 mmHg à 20°C |
| Densité de vapeur | 5.7 |
| pKa | 1.8 |
| pH | Sans objet (substance pure) |
Sécurité et dangers du tétrachloroéthylène
Le C2Cl4 peut être nocif s’il est inhalé, ingéré ou entre en contact avec la peau ou les yeux. Cela peut provoquer des étourdissements, des maux de tête, de la confusion et une irritation respiratoire. Une exposition à long terme peut entraîner des lésions hépatiques et rénales et augmenter le risque de certains cancers. Il est important de manipuler le C2Cl4 avec précaution et d’utiliser un équipement de protection approprié lorsque vous travaillez avec. La substance doit être stockée dans un endroit bien ventilé et tenue à l’écart des sources de chaleur ou d’ignition. Les déversements doivent être immédiatement nettoyés et éliminés correctement conformément aux réglementations locales.
| Symboles de danger | Crâne et os croisés, Flamme |
| Description de la sécurité | Facilement inflammable, Toxique en cas d’inhalation ou d’ingestion, Peut provoquer le cancer, Peut causer des lésions aux organes |
| ID ONU | ONU 1897 |
| Code SH | 290323 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | Le tétrachloroéthylène est classé comme cancérogène du groupe 2A (probablement cancérogène pour l’homme) par le Centre international de recherche sur le cancer (CIRC) et comme toxine pour la reproduction de catégorie 2 par l’Union européenne. |
Méthodes de synthèse du tétrachloroéthylène
Pour synthétiser le C2Cl4, on peut utiliser diverses méthodes, telles que la chloration directe de l’éthylène , la chloration du dichlorure d’éthylène ou la chloration du tétrachlorure de carbone.
L’éthylène gazeux réagit avec le chlore gazeux dans un réacteur pour former du C2Cl4 lors de la méthode de chloration directe. Cette méthode peut produire des rendements élevés de C2Cl4 mais nécessite un contrôle minutieux des conditions de réaction pour éviter les sous-produits indésirables.
La deuxième méthode implique la chloration du dichlorure d’éthylène, qui est un sous-produit de la production de chlorure de vinyle. Cette méthode produit également des rendements élevés en C2Cl4 mais peut entraîner la formation de sous-produits toxiques tels que l’hexachlorobutadiène.
La troisième méthode implique la chloration du tétrachlorure de carbone, qui peut produire du C2Cl4 comme sous-produit. Cependant, cette méthode est moins efficace et produit des rendements inférieurs à ceux des deux autres méthodes.
Outre ces méthodes, il est également possible de produire du C2Cl4 en faisant réagir du trichloréthylène avec du chlore gazeux ou en faisant réagir de l’hexachloroéthane avec du phosgène.
À l’échelle industrielle, les fabricants utilisent couramment la chloration directe de l’éthylène et la chloration du dichlorure d’éthylène comme méthodes les plus couramment utilisées pour produire du C2Cl4.
Utilisations du tétrachloroéthylène
Le C2Cl4 a plusieurs utilisations industrielles et commerciales, notamment :
- Nettoyage à sec : Largement utilisé comme solvant pour le nettoyage à sec des vêtements en raison de sa capacité à dissoudre un large éventail de taches et de salissures.
- Dégraissage des métaux : Un solvant efficace pour éliminer l’huile et la graisse des surfaces métalliques, ce qui le rend utile dans l’industrie métallurgique.
- Adhésifs et produits d’étanchéité : Utilisé comme solvant dans la fabrication d’adhésifs et de produits d’étanchéité, car il peut dissoudre de nombreux types de polymères et de résines.
- Intermédiaires chimiques : utilisés comme matière première dans la production d’autres produits chimiques, tels que les solvants chlorés et les fluorocarbures.
- Transformation du textile et du cuir : Utilisé dans la transformation du textile et du cuir comme solvant et pour éliminer les impuretés.
- Réfrigérant : Certaines applications utilisent le C2Cl4 comme réfrigérant, mais les préoccupations environnementales éliminent progressivement cette utilisation.
- Solvant de laboratoire : également utilisé comme solvant en laboratoire, en particulier pour les applications de chromatographie et de spectroscopie.
Des questions:
Q : Qu’est-ce que le tétrachloroéthylène ?
R : Le C2Cl4, également connu sous le nom de perchloréthylène ou PCE, est un liquide incolore à l’odeur douce qui est largement utilisé comme solvant dans diverses applications industrielles et commerciales.
Q : Le tétrachloroéthylène flottera-t-il sur l’eau ?
R : Non, le C2Cl4 est plus dense que l’eau, il coulera donc et formera une couche distincte au fond.
Q : Où acheter du solvant de nettoyage à sec au tétrachloroéthylène (perchloroéthylène) ?
R : Le C2Cl4 est une substance réglementée et ne peut être acheté que par des professionnels agréés du secteur du nettoyage à sec. Il est généralement acheté auprès de fournisseurs ou de distributeurs de produits chimiques spécialisés dans les solvants industriels.
Q : Quel est le lien entre le tétrachloroéthylène et le tétrachlorure de carbone ?
R : Le C2Cl4 et le tétrachlorure de carbone sont tous deux des hydrocarbures halogénés qui contiennent des atomes de chlore, mais ils ont des structures et des propriétés moléculaires différentes. Le tétrachlorure de carbone est une molécule non polaire, tandis que le C2Cl4 est polaire en raison de la présence d’une double liaison entre deux atomes de carbone.
Q : Tétrachloroéthylène dans l’eau ?
R : Le C2Cl4 n’est que légèrement soluble dans l’eau et a tendance à se répartir dans le sol et les sédiments, ce qui en fait un contaminant courant des eaux souterraines et du sol.
Q : Entreprises de tests de tétrachloroéthylène ?
R : De nombreuses sociétés d’analyses environnementales proposent des services d’analyse du C2Cl4 pour des échantillons d’eau, de sol et d’air. Quelques exemples incluent ALS Global, Eurofins TestAmerica et Environmental Testing and Consulting, Inc.
Q : Qu’est-ce que l’hybridation des atomes de C dans C2Cl4 ?
R : Les atomes de C dans C2Cl4 ont une hybridation sp2, ce qui signifie qu’ils ont trois orbitales hybrides impliquées dans la liaison avec d’autres atomes.
Q : Quel est l’angle approximatif de la liaison chlore-carbone-chlore dans C2Cl4 ?
R : L’angle approximatif de la liaison chlore-carbone-chlore dans C2Cl4 est de 120 degrés, ce qui est caractéristique des molécules à géométrie planaire trigonale.
Q : Le C2Cl4 est-il polaire ou non polaire ?
R : C2Cl4 est une molécule polaire en raison de la présence d’une double liaison entre les atomes de carbone, ce qui entraîne une répartition asymétrique de la charge et un moment dipolaire.
