Le tétrahydrofurane (THF) est un composé organique incolore. Il est couramment utilisé comme solvant dans diverses industries en raison de sa capacité à dissoudre un large éventail de substances.
| Nom UICPA | Oxolane |
| Formule moléculaire | C4H8O |
| Numero CAS | 109-99-9 |
| Synonymes | THF, oxacyclopentane, oxyde de butylène, oxyde de diéthylène, oxyde de cyclotétraméthylène |
| InChI | InChI=1S/C4H8O/c1-2-4-5-3-1/h1-4H2 |
Propriétés du tétrahydrofurane
Formule de tétrahydrofurane
Le tétrahydrofurane (THF) a une formule chimique C4H8O. C’est un éther cyclique avec un cycle à cinq chaînons contenant quatre atomes de carbone et un atome d’oxygène. Le THF a un point d’ébullition bas et est couramment utilisé comme solvant dans diverses industries.
Tétrahydrofurane Masse molaire
La masse molaire du THF est d’environ 72,11 g/mol. Cette valeur est calculée en additionnant les masses atomiques des atomes constitutifs dans la formule moléculaire. La masse molaire relativement faible du THF contribue à son faible point d’ébullition et à sa faible volatilité, ce qui en fait un solvant efficace pour une large gamme de composés organiques.
Point d’ébullition du tétrahydrofurane
Le point d’ébullition du THF est de 66°C (151°F) à pression atmosphérique standard. Le faible point d’ébullition du THF le rend utile comme solvant pour les réactions chimiques nécessitant des températures élevées, telles que les réactions de Grignard. Cependant, le point d’ébullition bas signifie également que le THF est très volatil, il faut donc être prudent lors de sa manipulation.
Tétrahydrofurane Point de fusion
Le point de fusion du THF est d’environ −108,5°C (−163,3°F). Le THF est liquide à température ambiante, mais il peut se solidifier à basse température. Le faible point de fusion du THF le rend utile comme solvant cryogénique pour les applications à basse température.
Densité du tétrahydrofurane g/mL
La densité du THF est d’environ 0,889 g/mL à 20°C (68°F). Cette valeur est relativement faible par rapport à d’autres solvants courants. La faible densité du THF le rend utile comme solvant pour les réactions sensibles à la densité, car il peut diminuer la densité globale du mélange réactionnel.
Tétrahydrofurane Poids moléculaire
Le poids moléculaire du THF est d’environ 72,11 g/mol. Cette valeur est calculée en additionnant les masses atomiques des atomes constitutifs dans la formule moléculaire. Le poids moléculaire relativement faible du THF contribue à son faible point d’ébullition et à sa volatilité.
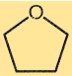
Structure du tétrahydrofurane
Le THF a une structure cyclique à cinq chaînons avec quatre atomes de carbone et un atome d’oxygène. Les atomes de carbone sont disposés selon une géométrie tétraédrique, chaque atome de carbone étant lié à deux autres atomes de carbone et à un atome d’hydrogène. L’atome d’oxygène est lié à un atome de carbone et à un atome d’hydrogène.
Solubilité du tétrahydrofurane
Le THF est un solvant polaire aprotique capable de dissoudre une large gamme de composés organiques. Le THF est miscible à l’eau et est couramment utilisé comme co-solvant dans diverses réactions chimiques. Cependant, le THF peut ne pas être compatible avec certains matériaux, il est donc important de vérifier sa compatibilité avant de l’utiliser.
| Apparence | Liquide incolore |
| Densité spécifique | 0,889 |
| Couleur | Incolore |
| Odeur | Odeur d’éther |
| Masse molaire | 72,11 g/mole |
| Densité | 0,889 g/ml |
| Point de fusion | −108,5°C (−163,3°F) |
| Point d’ébullition | 66°C (151°F) |
| Point d’éclair | −14°C (7°F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’éthanol, l’éther, l’acétone, le benzène |
| Pression de vapeur | 200 mmHg à 20°C |
| Densité de vapeur | 2,5 (air = 1) |
| pKa | 25.3 |
| pH | Neutre (7) |
Sécurité et dangers du tétrahydrofurane
Le tétrahydrofurane (THF) présente plusieurs risques pour la sécurité et la santé. Le THF est hautement inflammable et peut s’enflammer à température ambiante. Il peut également dégager des fumées toxiques lorsqu’il est chauffé ou brûlé. L’exposition au THF peut provoquer une irritation de la peau et des yeux, et une exposition prolongée peut entraîner des lésions hépatiques et rénales. Le THF est également connu pour provoquer des étourdissements et des maux de tête, et des inhalations répétées peuvent entraîner des problèmes respiratoires. Des précautions doivent être prises lors de la manipulation du THF et des équipements de protection tels que des gants et des lunettes de sécurité doivent être portés. Le THF doit être stocké dans un endroit frais et bien ventilé, loin des sources de chaleur et des matériaux incompatibles.
| Symboles de danger | Inflammable, Toxique |
| Description de la sécurité | Liquide et vapeurs hautement inflammables. Provoque une grave irritation des yeux. Peut provoquer somnolence ou vertiges. Peut être nocif en cas d’ingestion ou d’inhalation. |
| Numéros d’identification de l’ONU | UN2056 |
| Code SH | 29321100 |
| Classe de danger | 3 (Liquides inflammables) |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) – 5 410 mg/kg |
Méthodes de synthèse du tétrahydrofurane
Plusieurs méthodes permettent de synthétiser le Tétrahydrofurane (THF).
Une méthode courante implique l’hydrogénation catalytique du furane. Cela implique de faire passer de la vapeur de furane sur un catalyseur au nickel ou au palladium en présence d’hydrogène gazeux. La réaction qui en résulte produit du THF et de l’eau comme sous-produits.
Une autre méthode implique la réaction du 1,4-butanediol avec de l’acide sulfurique , suivie d’une distillation pour produire du THF. Les dangers de l’acide sulfurique concentré rendent cette méthode moins courante.
La déshydratation catalysée par un acide du 1,4-butanediol est une autre façon de synthétiser le THF. Cette méthode consiste à chauffer le 1,4-butanediol avec un acide fort, tel que l’acide sulfurique , pour éliminer l’eau et produire du THF.
De plus, on peut obtenir du THF par hydrogénolyse catalytique de la cellulose ou d’autres sucres dérivés de la biomasse. Cette méthode présente un intérêt croissant en raison du potentiel de sources renouvelables de production de THF.
Chaque méthode a ses avantages et ses inconvénients, et la méthode spécifique choisie dépendra de facteurs tels que le coût, la disponibilité des matières premières et la pureté souhaitée du produit final.
Utilisations du tétrahydrofurane
Le tétrahydrofurane (THF) a diverses applications industrielles et en laboratoire, notamment :
- Solvant : Couramment utilisé comme solvant pour divers composés organiques en raison de son pouvoir solvant élevé et de son faible point d’ébullition.
- Polymérisation : Utilisé comme co-solvant dans la polymérisation du polystyrène et du chlorure de polyvinyle, ainsi que dans la production de mousses de polyuréthane.
- Synthèse chimique : utilisé comme solvant de réaction dans la synthèse chimique organique, comme dans la préparation des réactifs de Grignard.
- Extraction : Utilisé comme solvant d’extraction pour divers produits naturels, tels que les alcaloïdes et les stéroïdes.
- Adhésifs : Utilisés comme composant dans les formulations adhésives, telles que celles utilisées dans la fabrication de chaussures et de cuir.
- Revêtements : Utilisés dans la production de revêtements et de vernis, ainsi que dans la formulation de peintures et de laques.
- Chimie analytique : utilisé comme solvant de phase mobile dans les analyses par chromatographie liquide haute performance (HPLC) et par chromatographie en phase gazeuse (GC).
Des questions:
Q : Quel est le principal produit organique formé lorsque le tétrahydrofurane est traité avec un excès de HBr ?
R : Lorsque le THF est traité avec un excès de HBr, le principal produit organique formé est le 3-bromo-1,4-dioxane.
Q : Le tétrahydrofurane est-il miscible à l’eau ?
R : Oui, le THF est miscible à l’eau. Il a une grande solubilité dans les solvants polaires, notamment l’eau.
Q : Le tétrahydrofurane endommagera-t-il le caoutchouc ?
R : Oui, le THF peut endommager le caoutchouc. Cela peut provoquer un gonflement, un ramollissement et une fissuration des matériaux en caoutchouc.
Q : Le tétrahydrofurane est-il polaire ou non polaire ?
R : Le THF est un solvant polaire. Il possède un moment dipolaire dû à l’atome d’oxygène présent dans sa structure cyclique, ce qui en fait un bon solvant pour les composés polaires.
Q : Le tétrahydrofurane explosera-t-il dans l’eau ?
R : Non, le THF n’explose pas dans l’eau. Cependant, il peut former un peroxyde explosif s’il est exposé à l’air pendant des périodes prolongées. Un stockage et une manipulation appropriés sont nécessaires pour éviter la formation de peroxydes.
Q : Quelle est la FDS du tétrahydrofurane ?
R : La FDS (fiche de données de sécurité) du THF fournit des informations sur ses propriétés physiques et chimiques, les instructions de manipulation et de stockage, les précautions de santé et de sécurité et les procédures d’intervention d’urgence. Il est important de consulter et de suivre les informations fournies dans la FDS lorsque vous travaillez avec THF.
