Le sulfate d’ammonium ((NH4)2SO4) est un engrais largement utilisé qui fournit des nutriments essentiels aux plantes. Il est également utilisé dans les retardateurs de flamme, dans la purification des protéines et comme additif alimentaire.
| Nom de l’UICPA | Tétraoxosulfate d’ammonium (VI) |
| Formule moléculaire | (NH4)2SO4 |
| Numero CAS | 7783-20-2 |
| Synonymes | Sulfate d’ammonium, sulfate d’ammonium (2:1), sulfate de diammonium, sel de diammonium de l’acide sulfurique, mascagnite, Actamaster, Dolamin |
| InChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Propriétés du sulfate d’ammonium
Formule de sulfate d’ammonium
La formule du sulfate d’ammonium est (NH4)2SO4. Cela signifie qu’une molécule de sulfate d’ammonium contient deux ions ammonium (NH4)+ et un ion sulfate (SO4)2-. Les ions ammonium et l’ion sulfate sont maintenus ensemble par des liaisons ioniques.
Sulfate D’Ammonium Masse molaire
La masse molaire de (NH4)2SO4 est 132,14 g/mol. Pour calculer la masse molaire, nous devons additionner les masses atomiques de tous les atomes de la formule. Les masses atomiques sont :
- Azote : 14,01 g/mol
- Hydrogène : 1,01 g/mol
- Soufre : 32,06 g/mol
- Oxygène : 16,00 g/mol
Ainsi, la masse molaire de (NH4)2SO4 est :
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Point d’ébullition du sulfate d’ammonium
Le point d’ébullition du (NH4)2SO4 n’est pas bien défini car il se décompose avant d’atteindre le point d’ébullition. Lorsqu’il est chauffé au-dessus de 235 °C, le (NH4)2SO4 commence à perdre de l’eau et à former du bisulfate d’ammonium (NH4)HSO4. Lorsqu’il est chauffé au-dessus de 280 °C, le bisulfate d’ammonium se décompose davantage en ammoniac (NH3) et acide sulfurique (H2SO4).
Sulfate d’ammonium Point de fusion
Le point de fusion du (NH4)2SO4 est de 235 °C. Il s’agit de la température à laquelle (NH4)2SO4 passe de l’état solide à l’état liquide. Cependant, comme mentionné ci-dessus, le (NH4)2SO4 commence également à se décomposer à cette température, ce n’est donc pas une phase liquide pure.
Densité du sulfate d’ammonium g/ml
La densité du (NH4)2SO4 est de 1,77 g/ml à température et pression ambiantes. Cela signifie qu’un millilitre de (NH4)2SO4 pèse 1,77 grammes. La densité d’une substance dépend de sa température et de sa pression, elle peut donc varier légèrement dans différentes conditions.
Ammonium Sulfate Poids moléculaire
Le poids moléculaire du (NH4)2SO4 est le même que sa masse molaire, qui est de 132,14 g/mol. Le poids moléculaire est la masse d’une mole d’une substance, qui est égale à 6,022 x 10^23 molécules. Le poids moléculaire peut également être exprimé en unités de masse atomique (amu), qui sont égales à 1/12 de la masse d’un atome de carbone 12. En amu, le poids moléculaire du (NH4)2SO4 est de 132,14 amu.
Structure du sulfate d’ammonium
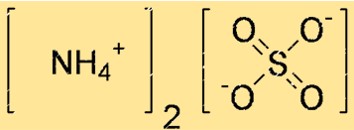
La structure du (NH4)2SO4 peut être représentée par une structure de points de Lewis ou un modèle boule-bâton. Une structure de points de Lewis montre les électrons de valence de chaque atome et les liaisons entre eux. Un modèle en forme de boule et de bâton montre la forme et la taille de chaque atome ainsi que les liaisons entre eux.
Dans la structure ci-dessus, les lignes doubles (=) représentent des doubles liaisons, les lignes simples (-) représentent des liaisons simples et les points (.) représentent des paires libres d’électrons.
Solubilité du sulfate d’ammonium
La solubilité du (NH4)2SO4 est la quantité de (NH4)2SO4 qui peut se dissoudre dans une quantité donnée d’eau à une température donnée. La solubilité du (NH4)2SO4 augmente avec l’augmentation de la température, comme le montrent les données suivantes :
| Température (°C) | Solubilité (g/100 ml d’eau) |
| 0 | 70,6 |
| Apparence | Fines granules ou cristaux hygroscopiques blancs |
| Densité spécifique | 1,77 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 132,14 g/mole |
| Densité | 1,77 g/cm3 |
| Point de fusion | 235 à 280 °C (se décompose) |
| Point d’ébullition | Sans objet (se décompose) |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 70,6 g pour 100 g d’eau (0 °C), 74,4 g pour 100 g d’eau (20 °C), 103,8 g pour 100 g d’eau (100 °C) |
| Solubilité | Insoluble dans l’acétone, l’alcool et l’éther |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 5,5 (pour l’ion ammonium) |
| pH | 5 à 6 (pour une solution à 5%) |
Sécurité et dangers du sulfate d’ammonium
Le (NH4)2SO4 n’est pas très dangereux pour la santé humaine, mais il peut provoquer une irritation de la peau, des yeux, du nez et de la gorge en cas de contact ou d’inhalation. Il peut également provoquer des nausées, des douleurs à l’estomac, de la diarrhée, des vomissements et une somnolence en cas d’ingestion. Il est nocif pour la vie aquatique et son rejet dans l’environnement doit être évité. Il se décompose lorsqu’il est chauffé au-dessus de 235 °C, formant des gaz toxiques tels que l’ammoniac et l’acide sulfurique. Il est généralement reconnu comme étant sans danger en tant qu’additif alimentaire, mais il peut provoquer des réactions allergiques ou des symptômes d’asthme chez certaines personnes.
| Symboles de danger | Pas nécessaire |
| Description de la sécurité | Éviter le rejet dans l’environnement. Éliminer le contenu/récipient dans une usine d’élimination des déchets agréée. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code HS | 31022100 |
| Classe de danger | N’est pas applicable |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) = 2 840 mg/kg |
Méthodes de synthèse du sulfate d’ammonium
On peut synthétiser le (NH4)2SO4 par diverses méthodes car il s’agit d’un sel inorganique. Certaines des méthodes courantes sont :
- Neutralisation de l’ammoniac et de l’acide sulfurique : Cette méthode consiste à mélanger de l’ammoniac gazeux ou une solution aqueuse avec de l’acide sulfurique et à évaporer l’eau pour obtenir des cristaux de (NH4)2SO4.
2NH3 + H2SO4 -> (NH4)2SO4
- Réaction du carbonate d’ammonium et du gypse : Cette méthode consiste à ajouter du gypse finement divisé ( sulfate de calcium ) à une solution de carbonate d’ammonium et à filtrer le précipité de carbonate de calcium.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Sous-produit d’autres procédés : Divers procédés industriels, tels que la purification des gaz de cokerie, la production de caprolactame, le raffinage du nickel et la désulfuration des gaz de combustion, peuvent produire du (NH4)2SO4 comme sous-produit. Ces processus utilisent de l’ammoniac ou des composés d’ammonium pour éliminer le soufre ou d’autres impuretés des flux gazeux, ce qui donne du (NH4)2SO4 comme déchet ou produit de valeur.
Utilisations du sulfate d’ammonium
Le (NH4)2SO4 est un sel inorganique qui a diverses utilisations, telles que :
- Engrais pour sols alcalins : (NH4)2SO4 abaisse le pH du sol et fournit de l’azote et du soufre pour la croissance des plantes. Il convient aux cultures qui nécessitent des sols acides, comme les bleuets, les pommes de terre et les tomates.
- Adjuvant de pulvérisation agricole : (NH4)2SO4 améliore l’efficacité des insecticides, herbicides et fongicides hydrosolubles en liant les ions fer et calcium qui peuvent interférer avec leur action. Il améliore également l’absorption du glyphosate et d’autres herbicides systémiques par les plantes.
- Purification des protéines : (NH4)2SO4 peut précipiter les protéines des solutions aqueuses en augmentant la force ionique et en réduisant la solubilité des protéines. On peut utiliser la méthode du relargage pour séparer les protéines en fonction de leur taille, de leur charge et de leur hydrophobie.
- Additif alimentaire : Divers produits alimentaires comme le pain, le fromage, le vin et les légumes en conserve utilisent le (NH4)2SO4 comme régulateur d’acidité, conditionneur de pâte, nutriment de levure et agent raffermissant. La FDA le reconnaît comme généralement sûr.
- Autres utilisations : On peut utiliser le (NH4)2SO4 pour fabriquer d’autres sels d’ammonium, des extincteurs, des retardateurs de flamme, le tannage du cuir, la teinture de textiles, la galvanoplastie des métaux et la chimie analytique.
Des questions:
Q : Quelle est la formule chimique du sulfate d’ammonium ?
R : La formule chimique du sulfate d’ammonium est (NH4)2SO4. Cela signifie qu’une molécule de sulfate d’ammonium contient deux ions ammonium (NH4)+ et un ion sulfate (SO4)2-.
Q : Le sulfate d’ammonium est-il soluble ?
R : (NH4)2SO4 est soluble dans l’eau, mais insoluble dans l’acétone, l’alcool et l’éther. Il peut dissoudre 70,6 grammes pour 100 grammes d’eau à 0 °C, 74,4 grammes pour 100 grammes d’eau à 20 °C et 103,8 grammes pour 100 grammes d’eau à 100 °C.
Q : Quelle quantité de sulfate d’ammonium par gallon d’eau ?
R : La quantité de (NH4)2SO4 par gallon d’eau dépend de la concentration souhaitée et de la température de l’eau. Par exemple, si la concentration souhaitée est de 10 % (p/v) et que la température de l’eau est de 20 °C, alors la quantité de (NH4)2SO4 par gallon d’eau est :
10 % (p/v) = 10 grammes pour 100 ml d’eau 1 gallon = 3 785,41 ml 10 grammes x 3 785,41 ml / 100 ml = 378,54 grammes Par conséquent, la quantité de (NH4)2SO4 par gallon d’eau est de 378,54 grammes.
Q : Une réaction se produit-elle lorsque des solutions aqueuses de sulfate d’ammonium et de chlorure de calcium sont combinées ?
R : Non, aucune réaction ne se produit lorsque des solutions aqueuses de (NH4)2SO4 et de chlorure de calcium sont combinées. En effet, les deux sels sont solubles dans l’eau et ne forment aucun précipité insoluble. La solution résultante contient quatre ions : ammonium (NH4)+, sulfate (SO4)2-, calcium (Ca2+) et chlorure (Cl)-.
Q : Comment précipiter les protéines avec du sulfate d’ammonium ?
R : Pour précipiter les protéines avec (NH4)2SO4, les étapes suivantes peuvent être suivies :
- Préparez une solution aqueuse de (NH4)2SO4 avec une concentration et un volume connus.
- Ajouter la solution protéique à la solution (NH4)2SO4 lentement et en remuant.
- Surveillez la turbidité ou la densité optique du mélange pour déterminer la quantité de précipitation de protéines.
- Centrifuger le mélange pour séparer le culot protéique du surnageant.
- Jeter le surnageant et laver le culot protéique avec un tampon ou de l’eau pour éliminer l’excès de sel.
- Remettre en suspension ou solubiliser le culot protéique dans un tampon approprié pour une analyse ou une utilisation ultérieure.
Q : Combien de grammes contiennent 6,90 molécules de sulfate d’ammonium ?
R : Pour savoir combien de grammes contiennent 6,90 molécules de (NH4)2SO4, nous devons utiliser le nombre d’Avogadro et la masse molaire de (NH4)2SO4. Le nombre d’Avogadro est 6,022 x 10^23, ce qui signifie qu’une mole de n’importe quelle substance contient autant de molécules. La masse molaire du (NH4)2SO4 est de 132,14 g/mol, ce qui signifie qu’une mole de (NH4)2SO4 pèse autant de grammes. Par conséquent, nous pouvons utiliser cette formule pour calculer combien de grammes il y a dans 6,90 molécules de (NH4)2SO4 :
grammes = molécules x masse molaire / nombre d’Avogadro grammes = 6,90 x 132,14 / 6,022 x 10^23 grammes = 1,52 x 10^-21 Par conséquent, il y a 1,52 x 10^-21 grammes dans 6,90 molécules de (NH4)2SO4.
Q : Quelle quantité de soufre dans le sulfate d’ammonium ?
R : (NH4)2SO4 contient 24 % de soufre en masse. Ceci peut être calculé en utilisant la formule de composition en pourcentage et les masses molaires de soufre et de (NH4)2SO4. La masse molaire du soufre est de 32,06 g/mol et la masse molaire du (NH4)2SO4 est de 132,14 g/mol. Par conséquent, le pourcentage de soufre dans (NH4)2SO4 est :
pourcentage = masse molaire de soufre x 100 / masse molaire de sulfate d’ammonium pourcentage = 32,06 x 100 / 132,14 pourcentage = 24,26 %
Q : Lequel de ces sels est un sel neutre ? na2so4 nacn kf (nh4)2so4
R : Un sel neutre est un sel qui n’affecte pas le pH de la solution lorsqu’il est dissous dans l’eau. Il est formé par la réaction d’un acide fort et d’une base forte. Sur les quatre sels donnés, seul na2so4 est un sel neutre. Il est formé par la réaction de l’hydroxyde de sodium (une base forte) et de l’acide sulfurique (un acide fort). Les autres sels sont soit acides, soit basiques. Le Nacn est un sel basique, formé par la réaction de l’hydroxyde de sodium (une base forte) et de l’acide cyanhydrique (un acide faible). Kf est un sel basique, formé par la réaction de l’hydroxyde de potassium (une base forte) et de l’acide fluorhydrique (un acide faible). (Nh4)2so4 est un sel acide, formé par la réaction de l’hydroxyde d’ammonium (une base faible) et de l’acide sulfurique (un acide fort).
Q : Quelle est la masse molaire de (nh4)2so4 ?
R : La masse molaire de (nh4)2so4 est de 132,14 g/mol. Pour trouver la masse molaire, nous devons additionner les masses atomiques de tous les atomes de la formule. Les masses atomiques sont :
- Azote : 14,01 g/mol
- Hydrogène : 1,01 g/mol
- Soufre : 32,06 g/mol
- Oxygène : 16,00 g/mol
Ainsi, la masse molaire de (nh4)2so4 est :
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Q : Le (nh4)2so4 est-il soluble dans l’eau ?
R : Oui, (nh4)2so4 est soluble dans l’eau. Il peut dissoudre jusqu’à 70,6 grammes pour 100 grammes d’eau à 0 °C, 74,4 grammes pour 100 grammes d’eau à 20 °C et 103,8 grammes pour 100 grammes d’eau à 100 °C.
