Le carbure de calcium est un composé chimique de formule CaC2. Il est principalement utilisé pour produire du gaz acétylène et du cyanamide calcique. Il réagit avec l’eau pour produire de l’acétylène gazeux et de l’hydroxyde de calcium. Les gens l’utilisent pour le soudage et l’éclairage.
| Nom de l’UICPA | Éthynediide de calcium |
| Formule moléculaire | CaC2 |
| Numero CAS | 75-20-7 |
| Synonymes | Acétylure de calcium, percarbure de calcium, dicarbure de calcium, carburo de calcium, carburo calcico, éthynediide de calcium |
| InChI | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Propriétés du carbure de calcium
Formule de carbure de calcium
La formule chimique du carbure de calcium est CaC2. Cela signifie qu’une molécule de carbure de calcium est constituée d’un atome de calcium et de deux atomes de carbone. La formule montre le rapport des éléments du composé.
Carbure De Calcium Masse molaire
La masse molaire du CaC2 est de 64,099 g/mol. Cela signifie qu’une mole de CaC2 a une masse de 64,099 grammes. La masse molaire est calculée en additionnant les masses atomiques des éléments de la formule. La masse atomique du calcium est de 40,078 g/mol et celle du carbone est de 12,011 g/mol.
Point d’ébullition du carbure de calcium
Le point d’ébullition du CaC2 est de 2 300 °C. Cela signifie que le CaC2 passe du liquide au gaz à cette température. Le point d’ébullition est influencé par les forces intermoléculaires et la pression atmosphérique. Le CaC2 possède de fortes liaisons ioniques qui nécessitent beaucoup d’énergie pour se rompre.
Carbure de calcium Point de fusion
Le point de fusion du CaC2 est de 2 160 °C. Cela signifie que le CaC2 passe du solide au liquide à cette température. Le point de fusion est également influencé par les forces intermoléculaires et la pression atmosphérique. Le CaC2 a un point de fusion élevé en raison de ses fortes liaisons ioniques.
Densité du carbure de calcium g/ml
La densité de CaC2 est de 2,22 g/ml. Cela signifie qu’un millilitre de CaC2 a une masse de 2,22 grammes. La densité est calculée en divisant la masse par le volume. La densité dépend de la configuration et de la disposition des atomes ou des molécules dans la substance. Le CaC2 a une densité élevée car ses atomes sont étroitement regroupés dans une structure cristalline.
Carbure De Calcium Poids moléculaire
Le poids moléculaire du CaC2 est de 64,099 uma (unités de masse atomique). Cela signifie qu’une molécule de CaC2 a une masse de 64,099 uma. Le poids moléculaire est calculé en multipliant les masses atomiques des éléments de la formule par leur nombre respectif d’atomes. La masse atomique du calcium est de 40,078 amu et celle du carbone est de 12,011 amu.
Structure en carbure de calcium
La structure du CaC2 est tétragonale, monoclinique ou monoclinique selon la phase (I, II ou III). Cela signifie que CaC2 a différentes formes et dispositions de ses atomes ou molécules dans différents états ou conditions. La structure est déterminée par la symétrie et la géométrie de la substance. CaC2 a une structure tétragonale en phase I, une structure monoclinique en phase II et une autre structure monoclinique en phase III.
Solubilité du carbure de calcium
La solubilité du CaC2 est une hydrolyse rapide dans l’eau. Cela signifie que le CaC2 réagit rapidement avec l’eau et forme du gaz acétylène et de l’hydroxyde de calcium comme produits. La solubilité est mesurée par la quantité de substance pouvant se dissoudre dans un solvant donné à une température et une pression données. La solubilité dépend de la nature et de la polarité de la substance et du solvant, ainsi que d’autres facteurs tels que le pH et la salinité.
| Apparence | Poudre blanche à cristaux gris/noirs ou solide cristallin incolore 3 |
| Densité spécifique | 2.22 |
| Couleur | Incolore (pur) ou gris/brun (qualité technique) |
| Odeur | Inodore (pur) ou semblable à l’ail (qualité technique) |
| Masse molaire | 64,099 g/mole |
| Densité | 2,22 g/cm3 |
| Point de fusion | 2160 °C |
| Point d’ébullition | 2300 °C |
| Point d’éclair | 305 °C (acétylène) |
| Solubilité dans l’eau | Hydrolyse rapide |
| Solubilité | Insoluble dans l’éthanol et l’éther |
| Pression de vapeur | Négligeable |
| Densité de vapeur | 2,21 (acétylène) |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du carbure de calcium
Le CaC2 est un produit chimique inflammable et dangereux. Il peut provoquer des risques d’incendie et d’explosion lorsqu’il entre en contact avec l’eau ou l’humidité. Il libère du gaz acétylène, qui est également inflammable et explosif. Le CaC2 peut également nuire à votre santé. Cela peut irriter la peau, les yeux et les poumons. Cela peut provoquer des éruptions cutanées, des lésions oculaires, de la toux et un essoufflement. Cela peut également provoquer une accumulation de liquide dans vos poumons si vous en inhalez une grande quantité. Vous devez éviter tout contact avec le CaC2 et porter un équipement de protection lors de sa manipulation. Vous devez également le conserver dans un récipient sec et fermé, à l’écart de toute source d’ignition.
| Symboles de danger | F (facilement inflammable), C (corrosif), W (réagit avec l’eau) |
| Description de la sécurité | S2 (conserver hors de portée des enfants), S7/8 (conserver le récipient bien fermé et au sec), S16 (conserver à l’écart des sources d’ignition), S26 (en cas de contact avec les yeux, rincer immédiatement avec beaucoup d’eau et consulter un médecin. conseils), S36/37/39 (porter des vêtements de protection adaptés, des gants et une protection des yeux/du visage), S43 (en cas d’incendie, utiliser du sable sec ou de la poudre chimique sèche), S45 (en cas d’accident ou de malaise, demander immédiatement un avis médical) |
| Numéros d’identification de l’ONU | ONU 1402 |
| Code HS | 28491000 |
| Classe de danger | 4.3 |
| Groupe d’emballage | je |
| Toxicité | DL50 par voie orale rat : 80 mg/kg, CL50 par inhalation rat : 1000 ppm/4h |
Méthodes de synthèse du carbure de calcium
Il existe différentes méthodes pour synthétiser le CaC2 à partir de sources d’oxyde de calcium et de carbone.
L’une des méthodes les plus courantes est la méthode du four à arc électrique. Dans ce processus, un arc électrique chauffe un mélange de chaux et de coke à environ 2 200°C. La réaction est endothermique et produit du CaC2 fondu et du monoxyde de carbone. Après avoir fondu, le CaC2 refroidit et les gens le broient en morceaux ou en poudre, selon l’utilisation prévue. Cette méthode a une consommation d’énergie et un coût d’équipement élevés.
Une autre méthode est la méthode à l’état solide. Pour effectuer cette méthode, chauffez un mélange d’ oxyde de calcium et de biochar ou de charbon dérivé de la biomasse dans un four à environ 1 750 °C. La réaction est solide-solide et produit du CaC2 solide et du monoxyde de carbone. Vous pouvez directement utiliser ou traiter ultérieurement le solide CaC2. Cette méthode a une consommation d’énergie et un coût d’équipement inférieurs à ceux de la méthode du four à arc électrique.
Une troisième méthode est la méthode de substitution de la qualité de l’électricité du coke de charbon. Pour réaliser le procédé, on mélange du charbon de bas rang et de la chaux , on forme des pellets, puis on les pyrolyse dans un four à 1000°C. Le gaz produit génère de l’électricité, et on transfère les pellets chauds dans un four à CaC2 à 2000°C. La réaction est solide-solide et produit du CaC2 fondu et du monoxyde de carbone. Après refroidissement, le CaC2 fondu subit un broyage pour former des grumeaux ou de la poudre. Cette méthode présente une efficacité énergétique et une utilisation des ressources plus élevées que la méthode du four à arc électrique.
Utilisations du carbure de calcium
- Lorsque le CaC2 réagit avec l’eau, il produit de l’acétylène gazeux et de l’hydroxyde de calcium. L’acétylène gazeux est un intermédiaire important pour la synthèse de nombreux produits chimiques organiques et polymères, tels que le chlorure de polyvinyle, l’acétate de vinyle, le 1,4-butanediol, etc. L’hydroxyde de calcium est un composé polyvalent aux utilisations multiples.
- Pour produire du cyanamide calcique, les humains réagissent au CaC2 avec de l’azote à haute température. Le cyanamide de calcium agit comme un engrais azoté, un herbicide et un défoliant.
- Pour réduire la teneur en soufre du fer, de la fonte, de la fonte et de l’acier, on utilise du CaC2. Ce composé chimique réagit avec le soufre pour former du sulfure de calcium, désulfurant efficacement le métal. Ce processus améliore la qualité et la ductilité des produits sidérurgiques.
- Les lampes au carbure utilisent du CaC2 pour produire du gaz acétylène qui, une fois brûlé, génère de la lumière. Ces lampes étaient populaires dans les industries minière, spéléologique, cycliste et automobile avant que les lampes électriques ne deviennent courantes.
- Les gens utilisent le CaC2 comme agent de maturation des fruits comme les bananes, les mangues et les papayes. Il libère du gaz éthylène, qui accélère le processus de maturation et rehausse la couleur et la douceur des fruits. De nombreux pays considèrent la pratique consistant à utiliser des résidus de CaC2 pour faire mûrir les fruits comme illégale et nocive en raison des risques sanitaires qui y sont associés.
- Les gens utilisent le CaC2 dans les canons en bambou et les canons big-bang pour faire des bruits forts. Lorsqu’il est mélangé à de l’eau, il produit du gaz acétylène qui s’enflamme pour créer une expérience amusante et festive pour tous.
- Également utilisé comme désoxydant dans la fabrication de l’acier. Il élimine l’oxygène de l’acier en fusion et empêche la formation d’oxydes pouvant altérer la qualité des produits en acier.
Des questions:
Q : Où acheter du carbure de calcium localement ?
R : Vous pourrez peut-être trouver de petites quantités de CaC2 dans votre région dans certaines quincailleries ou magasins de fournitures de soudage. Toutefois, si vous avez besoin de grandes quantités de CaC2, il peut être préférable de l’importer directement des fabricants. Vous pouvez contacter certains fournisseurs en ligne.
Q : Comment éliminer le carbure de calcium ?
R : Le CaC2 est un déchet dangereux et doit être éliminé correctement. Vous ne devez pas le jeter à la poubelle ou dans les égouts, car il peut réagir avec l’eau et produire du gaz acétylène, inflammable et explosif. Vous devez contacter votre autorité locale de gestion des déchets dangereux ou une entreprise d’élimination des déchets agréée pour obtenir des conseils sur la façon d’éliminer en toute sécurité le CaC2. Il faudra peut-être le neutraliser avec de l’eau dans un endroit bien ventilé, puis l’emballer dans un récipient scellé pour le transport.
Q : Que se forme-t-il lorsque le carbure de calcium réagit avec l’eau lourde ?
R : L’eau lourde est de l’eau qui contient du deutérium au lieu de l’hydrogène. Le deutérium est un isotope de l’hydrogène qui possède un proton et un neutron dans son noyau. Lorsque le CaC2 réagit avec l’eau lourde, il forme de l’hydroxyde de calcium et de l’acétylène deutéré. L’acétylène deutéré est de l’acétylène qui contient du deutérium au lieu de l’hydrogène. L’équation chimique de cette réaction est :
CaC2 + 2D2O -> Ca(OD)2 + C2D2
Q : Le carbure de calcium est-il dangereux ?
R : Oui, le CaC2 est dangereux et doit être manipulé avec précaution. Il peut provoquer des risques d’incendie et d’explosion lorsqu’il entre en contact avec l’eau ou l’humidité, car il libère du gaz acétylène, qui est également inflammable et explosif. Cela peut également nuire à votre santé, car cela peut irriter votre peau, vos yeux et vos poumons. Le CaC2 peut provoquer des éruptions cutanées, des lésions oculaires, de la toux et un essoufflement. Cela peut également provoquer une accumulation de liquide dans vos poumons si vous en inhalez une grande quantité. Vous devez éviter tout contact avec le CaC2 et porter un équipement de protection lors de sa manipulation. Vous devez également le conserver dans un récipient sec et fermé, à l’écart de toute source d’ignition.
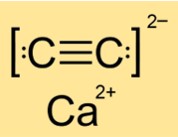
Q : Le carbure de calcium est-il ionique ou covalent ?
R : CaC2 est un composé ionique. Il est constitué d’ions calcium (Ca2+) et d’ions carbure (C22-). Les composés ioniques se forment lorsque les atomes métalliques perdent des électrons et que les atomes non métalliques en gagnent pour obtenir des configurations électroniques stables. Les ions résultants sont maintenus ensemble par des forces d’attraction électrostatiques. Le CaC2 possède de fortes liaisons ioniques qui nécessitent beaucoup d’énergie pour se rompre.
Q : Comment est fabriqué le carbure de calcium ?
R : Le CaC2 est obtenu en chauffant un mélange de chaux (oxyde de calcium) et de coke (carbone) à environ 2 200 °C dans un four à arc électrique. La réaction est endothermique et produit du CaC2 fondu et du monoxyde de carbone. Le CaC2 fondu est ensuite refroidi et broyé en morceaux ou en poudre. Cette méthode a une consommation d’énergie et un coût d’équipement élevés. Il existe également d’autres méthodes qui utilisent différentes sources de carbone, comme le biocharbon ou le charbon de rang inférieur, et différentes méthodes de chauffage, comme le chauffage à l’état solide ou le chauffage par induction. Ces méthodes peuvent avoir une consommation d’énergie et un coût d’équipement inférieurs à ceux de la méthode du four à arc électrique.
Q : Puis-je transformer le carbonate de calcium en carbure de calcium ?
R : Non, vous ne pouvez pas transformer directement le carbonate de calcium en CaC2. Le carbonate de calcium est un composé stable qui ne réagit pas avec le carbone à haute température. Il faut d’abord convertir le carbonate de calcium en oxyde de calcium en le chauffant fortement en l’absence d’air (calcination). Ensuite, vous pouvez faire réagir l’oxyde de calcium avec le carbone à haute température pour produire du CaC2 (carburation). L’équation chimique globale de ce processus est la suivante :
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
Q : Qu’est-ce qui est vrai pour la réaction suivante ? Ca(s) + 2C(s) -> CaC2(s) + 62,8 kJ
R : Les affirmations suivantes sont vraies pour la réaction :
- Il s’agit d’une réaction de synthèse dans laquelle deux ou plusieurs éléments se combinent pour former un composé.
- Il s’agit d’une réaction exothermique, où la chaleur est libérée dans l’environnement.
- Il s’agit d’une réaction redox, où le calcium est oxydé et le carbone est réduit.
- C’est la réaction inverse de la formation de CaC2 à partir de l’oxyde de calcium et du carbone.
Q : Quelle est la chaleur standard de formation de cac2(s) ?
R : La chaleur standard de formation de cac2(s) est le changement d’enthalpie lorsqu’une mole de CaC2 est formée à partir de ses éléments dans leurs états standard à 25 °C et 1 atm. Il peut être calculé à partir des équations thermochimiques données en utilisant la loi de Hess. L’équation globale pour la formation de CaC2 est :
Ca(s) + 2C(s) -> CaC2(s)
En utilisant la loi de Hess, on peut écrire :
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Par conséquent, la chaleur standard de formation de cac2(s) est de -680,10 kJ/mol.
Q : Combien de grammes de cac2 seraient nécessaires pour générer 0,35 mole de hcch(g) ?
R : Pour répondre à cette question, nous devons utiliser l’équation équilibrée de la réaction entre le CaC2 et l’eau :
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
À partir de cette équation, nous pouvons voir qu’une mole de cac2 produit une mole de hcch (également appelé acétylène). Par conséquent, pour générer 0,35 mole de hcch, nous avons besoin de 0,35 mole de cac2. Pour convertir des moles en grammes, nous devons utiliser la masse molaire de cac2, qui est de 64,099 g/mol. En multipliant les taupes par la masse molaire, on obtient :
0,35 mole x 64,099 g/mole = 22,435 g
Par conséquent, nous avons besoin de 22,435 grammes de cac2 pour générer 0,35 mole de hcch.
Q : Combien de moles de cac2 sont nécessaires pour réagir complètement avec 49,0 g d’eau ?
R : Pour répondre à cette question, nous devons utiliser l’équation équilibrée de la réaction entre le carbure de calcium et l’eau :
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
A partir de cette équation, nous pouvons voir qu’une mole de cac2 réagit avec deux moles d’h2o. Par conséquent, pour trouver les moles de cac2 nécessaires, nous devons diviser les moles d’h2o par deux. Pour convertir des grammes en moles, nous devons utiliser la masse molaire de l’eau, qui est de 18,015 g/mol. En divisant les grammes par la masse molaire, on obtient :
49,0 g / 18,015 g/mol = 2,72 mole
En divisant cela par deux, on obtient :
2,72 moles / 2 = 1,36 moles
Par conséquent, nous avons besoin de 1,36 moles de cac2 pour réagir complètement avec 49,0 g d’h2o.
Q : Quels sont les produits de la réaction entre le carbure de calcium et l’eau ?
R : Les produits de la réaction entre le CaC2 et l’eau sont l’acétylène gazeux et une solution d’hydroxyde de calcium.
