L’acétate de zinc (Zn(C2H3O2)2) est un composé chimique. Ses utilisations sont nombreuses dans les industries et les laboratoires. Il est soluble dans l’eau et peut former des structures cristallines blanches.
| Nom UICPA | Acétate de Zinc |
| Formule moléculaire | Zn(C2H3O2)2 |
| Numero CAS | 557-34-6 |
| Synonymes | Diacétate de zinc, éthanoate de zinc, sel de zinc d’acide acétique |
| InChI | InChI=1S/2C2H4O2.Zn/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriétés de l’acétate de zinc
Formule d’acétate de zinc
La formule chimique de l’éthanoate de zinc est Zn(C2H3O2)2. Il se compose d’un ion zinc (Zn) et de deux ions acétate (C2H3O2). La formule représente le rapport des atomes présents dans le composé.
Acétate De Zinc Masse molaire
La masse molaire de l’éthanoate de zinc peut être calculée en additionnant les masses atomiques de chaque élément de la formule. Pour le zinc (Zn), la masse atomique est de 65,38 g/mol, et pour l’acétate (C2H3O2), elle est de 59,05 g/mol. Ainsi, la masse molaire de l’éthanoate de zinc est d’environ 183,39 g/mol.
Point d’ébullition de l’acétate de zinc
L’éthanoate de zinc n’a pas de point d’ébullition distinct, car il a tendance à se décomposer et à perdre de l’acide acétique lorsqu’il est chauffé. Au lieu de cela, il se décompose en oxyde de zinc et acide acétique à haute température.
Point de fusion de l’acétate de zinc
L’éthanoate de zinc a un point de fusion d’environ 237°C (459°F). A cette température, le composé solide se transforme à l’état liquide. Le point de fusion est une caractéristique importante utilisée pour l’identification.
Densité d’acétate de zinc g/mL
La densité de l’éthanoate de zinc est d’environ 1,84 g/mL. La densité est la mesure de la masse par unité de volume d’une substance. La densité de l’éthanoate de zinc est relativement élevée, ce qui indique sa compacité.
Zinc Acétate Poids moléculaire
Le poids moléculaire de l’éthanoate de zinc est de 183,39 g/mol. C’est la somme des poids atomiques de tous les atomes du composé. Le poids moléculaire est crucial pour divers calculs et réactions chimiques.
Structure en acétate de zinc
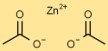
L’éthanoate de zinc a une structure simple, avec l’ion zinc (Zn) en son centre entouré de deux ions acétate (C2H3O2). Les ions acétate forment des liaisons covalentes coordonnées avec l’ion zinc.
Solubilité de l’acétate de zinc
L’éthanoate de zinc est soluble dans l’eau et d’autres solvants polaires. La solubilité dans l’eau est relativement élevée et forme une solution incolore. La solubilité du composé est essentielle pour ses diverses applications dans les industries et les laboratoires.
| Propriété | Valeur |
| Apparence | Cristaux blancs |
| Gravité spécifique | 1,84 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 183,39 g/mole |
| Densité | 1,84 g/cm³ |
| Point de fusion | 237°C (459°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau et autres solvants polaires |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Neutre (7) |
Sécurité et dangers de l’acétate de zinc
L’éthanoate de zinc présente des risques minimes pour la sécurité lorsqu’il est manipulé correctement. Cela peut provoquer une légère irritation de la peau et des yeux. Évitez l’inhalation ou l’ingestion, car cela peut entraîner une gêne respiratoire et gastro-intestinale. Conserver dans un endroit frais et sec, à l’écart des substances incompatibles. Porter un équipement de protection approprié lors de la manipulation. En cas de contact, rincer abondamment à l’eau les zones concernées. Consulter un médecin si l’irritation persiste. Suivez les bonnes pratiques de laboratoire et les consignes de sécurité pour prévenir les accidents. Bien qu’il soit généralement sûr, une manipulation responsable et des mesures de précaution sont essentielles pour garantir un environnement de travail sûr.
| Symboles de danger | Aucun |
| Description de la sécurité | Provoque une légère irritation cutanée, Provoque une irritation des yeux, Éviter l’inhalation/l’ingestion. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 29152900 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’acétate de zinc
Il existe plusieurs méthodes pour synthétiser l’éthanoate de zinc. Une approche courante implique la réaction entre l’oxyde de zinc (ZnO) et l’acide acétique (CH3COOH) . Les deux substances sont mélangées et la réaction a lieu à température élevée. Au cours du processus, l’oxyde de zinc réagit avec l’acide acétique, entraînant la formation d’éthanoate de zinc et d’eau.
Une autre méthode implique la réaction du zinc métallique avec l’acide acétique . Le zinc métallique est ajouté à l’acide acétique et la réaction se produit, produisant de l’éthanoate de zinc et de l’hydrogène gazeux.
Alternativement, l’éthanoate de zinc peut être préparé en faisant réagir du carbonate de zinc (ZnCO3) avec de l’acide acétique. Le carbonate de zinc réagit avec l’acide acétique pour produire de l’éthanoate de zinc, du dioxyde de carbone et de l’eau.
De plus, l’éthanoate de zinc peut être obtenu en traitant l’hydroxyde de zinc (Zn(OH)2) avec de l’acide acétique. La réaction entre ces substances donne de l’éthanoate de zinc et de l’eau.
Quelle que soit la méthode utilisée, l’éthanoate de zinc obtenu peut être purifié davantage par des processus de cristallisation ou de filtration. Des précautions doivent être prises lors de la synthèse pour garantir la sécurité et obtenir un produit de haute qualité.
Utilisations de l’acétate de zinc
L’éthanoate de zinc trouve un large éventail d’applications dans diverses industries en raison de ses propriétés polyvalentes. Certaines de ses utilisations courantes incluent :
- Industrie pharmaceutique : l’éthanoate de zinc contribue activement à la fonction immunitaire et à la cicatrisation des plaies, car les sociétés pharmaceutiques l’incorporent dans divers médicaments et compléments alimentaires pour fournir une source de zinc.
- Industrie textile : Dans l’industrie textile, il sert de mordant dans les processus de teinture pour fixer et améliorer la solidité des couleurs des teintures textiles sur les tissus.
- Synthèse chimique : L’éthanoate de zinc agit comme un catalyseur dans les réactions organiques, facilitant les processus d’estérification et d’acétylation.
- Préservation du bois : les formulations de traitement du bois utilisent de l’éthanoate de zinc pour protéger contre les attaques de champignons et de termites, prolongeant ainsi la durée de vie des produits du bois.
- Galvanisation : Dans la galvanisation, l’éthanoate de zinc sert de précurseur dans la production de revêtements de zinc, offrant une résistance à la corrosion à l’acier et à d’autres métaux.
- Applications en laboratoire : Les chercheurs et les scientifiques utilisent l’éthanoate de zinc comme réactif dans diverses expériences de laboratoire et procédures analytiques.
- Produits de soins de la peau : les pommades et les crèmes contiennent de l’éthanoate de zinc pour ses propriétés astringentes et apaisantes, bénéfiques pour les affections cutanées comme l’acné.
- Dégivreur : Certaines régions utilisent l’éthanoate de zinc comme dégivreur écologique sur les routes et les trottoirs en hiver afin de prévenir la formation de glace.
- Désulfuration des gaz : l’éthanoate de zinc trouve une application dans les processus d’épuration des gaz pour éliminer les composés soufrés des émissions industrielles.
- Industrie alimentaire : Dans l’industrie alimentaire, l’éthanoate de zinc agit comme un additif alimentaire, servant de régulateur d’acidité et de stabilisant dans certains aliments transformés.
Dans l’ensemble, les diverses applications de l’éthanoate de zinc démontrent son importance dans plusieurs industries, ce qui en fait un composé précieux dans divers processus de fabrication et de recherche.
Des questions:
Q : Quelle substance est importante dans la fabrication des plastiques ?
R : L’acide acétique est essentiel dans la fabrication des plastiques car il est couramment utilisé comme matière première dans la production de divers polymères synthétiques.
Q : Qu’est-ce que l’acétate de zinc ?
R : L’éthanoate de zinc est un composé chimique formé par la réaction de l’oxyde de zinc ou du zinc métallique avec de l’acide acétique, donnant lieu à un solide cristallin blanc.
Q : Quelle est la formule de l’acétate de zinc ?
R : La formule de l’éthanoate de zinc est Zn(C2H3O2)2.
Q : L’acétate de zinc est-il soluble ?
R : Oui, l’éthanoate de zinc est soluble dans l’eau et d’autres solvants polaires.
Q : L’acétate de zinc et le gluconate de zinc sont-ils des anticoagulants ?
R : Non, l’éthanoate de zinc et le gluconate de zinc ne sont pas des anticoagulants. Ce sont des formes de zinc utilisées comme compléments alimentaires.
Q : L’acide acétique de zinc est-il un solide ?
R : L’acide acétique de zinc n’est pas un composé spécifique. Il peut faire référence au produit de réaction du zinc avec l’acide acétique, qui serait un composé de zinc solide.
Q : Quel élément et quel composé ont la même réaction chimique que le zinc et l’acide acétique ?
R : L’élément est le zinc (Zn) et le composé est l’oxyde de zinc (ZnO), qui réagissent de la même manière que le zinc et l’acide acétique.
Q : Quelle est l’équation équilibrée du zinc et de l’acide acétique ?
R : L’équation équilibrée est : Zn + 2CH3COOH → Zn(CH3COO)2 + H2.
Q : Que fait l’acétate de zinc pour la peau ?
R : L’éthanoate de zinc est utilisé dans les produits de soin de la peau pour ses propriétés astringentes, aidant à apaiser et à soulager les affections cutanées comme l’acné.
