L’anhydride maléique (C4H2O3) est un composé chimique utilisé dans diverses industries. Il est produit par oxydation du benzène ou du butane. Il est principalement utilisé dans la production de polymères, de résines et de produits chimiques agricoles.
| Nom UICPA | L’anhydride maléique |
| Formule moléculaire | C4H2O3 |
| Numero CAS | 108-31-6 |
| Synonymes | Anhydride cis-butènedioïque, 2,5-furandione, anhydride toxique, anhydride d’acide maléique |
| InChI | InChI=1S/C4H2O3/c5-3-1-2-4(6)7-3/h1-2H |
Propriétés de l’anhydride maléique
Formule d’anhydride maléique
La formule de l’anhydride maléique est C4H2O3. Il se compose de quatre atomes de carbone, deux atomes d’hydrogène et trois atomes d’oxygène. La disposition de ces atomes confère à l’anhydride maléique ses propriétés chimiques uniques.
Anhydride Maléique Masse molaire
La masse molaire de l’anhydride butènedioïque est calculée en additionnant les masses atomiques de ses éléments constitutifs. L’anhydride maléique a une masse molaire d’environ 98,06 grammes par mole. Cette valeur est essentielle pour divers calculs en chimie et dans les procédés de fabrication.
Point d’ébullition de l’anhydride maléique
L’anhydride butènedioïque a un point d’ébullition d’environ 202,2 degrés Celsius (396,0 degrés Fahrenheit). Il s’agit de la température à laquelle le composé passe de l’état liquide à l’état gazeux lorsqu’il est chauffé. Le point d’ébullition est une caractéristique importante pour déterminer les conditions requises pour son utilisation.
Anhydride maléique Point de fusion
Le point de fusion de l’anhydride butènedioïque est d’environ 52,8 degrés Celsius (127,0 degrés Fahrenheit). C’est la température à laquelle le composé solide se transforme à l’état liquide. Le point de fusion est un paramètre crucial pour la manipulation et le traitement de l’anhydride butènedioïque.
Densité de l’anhydride maléique g/mL
La densité de l’anhydride butènedioïque est d’environ 1,48 grammes par millilitre (g/mL). La densité mesure la masse d’une substance par unité de volume. Cette valeur aide à comprendre la concentration et le comportement de l’anhydride butènedioïque dans diverses applications.
Anhydride Maléique Poids moléculaire
Le poids moléculaire de l’anhydride butènedioïque est d’environ 98,06 grammes par mole. Il est calculé en additionnant les poids atomiques de ses atomes constitutifs. Le poids moléculaire est important pour déterminer la quantité d’anhydride butènedioïque nécessaire dans les réactions et pour comprendre ses propriétés chimiques.
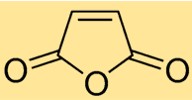
Structure de l’anhydride maléique
La structure de l’anhydride butènedioïque est constituée d’une molécule cyclique avec une double liaison entre deux atomes de carbone et deux atomes d’oxygène attachés au squelette carboné. Cette structure confère une réactivité et des caractéristiques spécifiques à l’anhydride butènedioïque, ce qui le rend utile dans divers processus chimiques.
Solubilité de l’anhydride maléique
L’anhydride butènedioïque est peu soluble dans l’eau mais se dissout facilement dans les solvants organiques tels que l’acétone, le benzène et l’acétate d’éthyle. Ce comportement de solubilité permet une incorporation facile de l’anhydride butènedioïque dans différentes solutions et facilite son utilisation dans diverses applications industrielles.
| Apparence | Cristallin blanc |
| Gravité spécifique | 1,48 g/ml |
| Couleur | Incolore |
| Odeur | Odeur âcre |
| Masse molaire | 98,06 g/mole |
| Densité | 1,48 g/ml |
| Point de fusion | 52,8 °C (127,0 °F) |
| Point d’ébullition | 202,2 °C (396,0 °F) |
| Point d’éclair | 138 °C (280 °F) |
| Solubilité dans l’eau | 44 g/L à 20 °C |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 0,3 mmHg à 20 °C |
| Densité de vapeur | 3,39 (Air = 1) |
| pKa | 1.2 |
| pH | ~1 (solution saturée) |
Sécurité et dangers de l’anhydride maléique
L’anhydride butènedioïque présente certains risques pour la sécurité et doit être manipulé avec prudence. Il peut provoquer une irritation de la peau, des yeux et du système respiratoire par contact ou par inhalation. Un contact direct avec la peau peut entraîner des brûlures ou une dermatite. Des mesures de protection adéquates telles que des gants, des lunettes et une protection respiratoire doivent être utilisées lorsque vous travaillez avec ce composé. Il est important d’éviter l’inhalation de ses vapeurs ou poussières, car elles peuvent irriter les voies respiratoires. L’anhydride butènedioïque doit être stocké dans un endroit frais et bien ventilé, à l’écart des substances incompatibles. Une manipulation appropriée et le respect des protocoles de sécurité sont essentiels pour minimiser les risques associés à ce produit chimique.
| Symboles de danger | XI |
| Description de la sécurité | Irritant |
| Numéros d’identification de l’ONU | UN2215 |
| Code SH | 2917.12.000 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | III |
| Toxicité | Nocif en cas d’ingestion ou d’inhalation, provoque une irritation |
Méthodes de synthèse de l’anhydride maléique
Diverses méthodes peuvent synthétiser l’anhydride butènedioïque. Une méthode courante consiste à oxyder catalytiquement le benzène en le faisant réagir avec de l’air ou de l’oxygène en présence d’un catalyseur approprié, tel que le pentoxyde de vanadium ou un oxyde métallique. La réaction se produit à des températures élevées, généralement autour de 300 à 400 degrés Celsius, et produit de l’anhydride butènedioïque.
Une autre méthode consiste à oxyder catalytiquement le butane ou le n-butane. Ce procédé utilise des catalyseurs comme des catalyseurs à base de vanadium ou de molybdène à haute température. Cela implique plusieurs étapes de réaction, y compris la formation d’acide butènedioïque comme intermédiaire, qui subit une déshydratation pour donner de l’anhydride butènedioïque.
La réaction de l’acide butènedioïque avec l’anhydride acétique est une autre méthode. Dans ce cas, l’acide butènedioïque réagit avec l’anhydride acétique en présence d’un catalyseur comme l’acide sulfurique . La réaction a lieu dans des conditions de reflux, entraînant la production d’anhydride butènedioïque comme produit final.
De plus, l’oxydation catalytique d’hydrocarbures comme le n-butène ou de dérivés du benzène comme l’orthoxylène ou le métaxylène permet la synthèse d’anhydride butènedioïque. Ces réactions utilisent des conditions et des catalyseurs similaires mentionnés précédemment.
Le choix de la méthode de synthèse appropriée dépend de facteurs tels que la disponibilité des matières premières, l’échelle de production souhaitée et l’économie du processus. Chaque méthode présente ses propres avantages et limites en termes de coût, de rendement et de considérations environnementales. Par conséquent, la sélection de la méthode de synthèse appropriée est cruciale pour produire efficacement de l’anhydride butènedioïque.
Utilisations de l’anhydride maléique
L’anhydride maléique trouve de nombreuses applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations clés :
- L’anhydride butènedioïque joue un rôle crucial dans la production de polymères tels que le succinate de polybutylène (PBS), les résines polyester insaturées et les résines alkydes. Ces polymères trouvent des applications dans les revêtements, les adhésifs et les matériaux composites.
- Il contribue à la création d’herbicides et de pesticides, agissant comme intermédiaire dans la synthèse d’agents efficaces de lutte contre les mauvaises herbes comme le dicamba et l’hydrazide butènedioïque.
- L’industrie pharmaceutique l’utilise dans la synthèse de divers intermédiaires pharmaceutiques et ingrédients actifs, contribuant ainsi au développement de médicaments pour traiter l’hypertension, l’inflammation et le cancer.
- Les polymères à base d’anhydride butènedioïque servent activement d’inhibiteurs de tartre et de corrosion dans les processus de traitement de l’eau, contrôlant activement l’accumulation de dépôts minéraux et protégeant activement les infrastructures.
- Il trouve son utilité dans la production d’agents d’encollage pour l’industrie du papier et du carton, améliorant la résistance à l’eau, l’imprimabilité et la résistance du papier.
- L’industrie textile l’utilise pour fabriquer des auxiliaires textiles, notamment des colorants, des agents fixateurs de teinture et des agents de finition, améliorant la solidité des couleurs et les performances du tissu.
- Les dérivés de l’anhydride butènedioïque servent d’additifs alimentaires, fonctionnant comme agents gélifiants, stabilisants ou acidulants dans divers produits alimentaires.
- Ils jouent activement un rôle dans la production d’additifs pour lubrifiants qui améliorent activement les performances et la longévité des huiles lubrifiantes, améliorant ainsi activement leur efficacité globale.
Le large éventail d’applications met en évidence l’importance de l’anhydride butènedioïque dans divers secteurs, ce qui en fait un composé précieux dans les processus industriels et le développement de produits.
Des questions:
Q : Quel est le produit de l’anhydride maléique et du e e-2 4-hexadien-1-ol ?
R : Le produit est un adduit Diels-Alder, en particulier le cis-N-éthyl-3-méthyl-4-phénylsuccinimide.
Q : Quel est le rôle de l’anhydride maléique dans la réaction de Diels-Alder ?
R : L’anhydride butènedioïque agit comme un diénophile, réagissant avec les diènes pour former des adduits cycliques.
Q : L’anhydride maléique nuit-il aux organismes aquatiques ?
R : Oui, l’anhydride butènedioïque peut être nocif pour les organismes aquatiques en raison de sa toxicité et de son potentiel d’effets indésirables.
Q : Si l’on utilise de l’anthracène et de l’anhydride maléique, quelle est la masse molaire du produit ?
R : La masse molaire du produit formé à partir d’anthracène et d’anhydride butènedioïque dépend de la réaction spécifique et de l’adduit résultant.
Q : L’anhydride maléique est-il aromatique ?
R : Oui, l’anhydride butènedioïque est considéré comme aromatique en raison de la présence d’un système conjugué cyclique.
Q : Pourquoi les flacons d’anhydride maléique doivent-ils être bien fermés lorsqu’ils ne sont pas utilisés ?
R : L’anhydride butènedioïque est très réactif et peut facilement subir des réactions indésirables avec l’humidité et l’air. Garder les bouteilles bien fermées permet d’éviter les réactions indésirables et de maintenir sa qualité.
Q : L’anhydride maléique est-il polaire ?
R : Oui, l’anhydride butènedioïque est polaire en raison de la présence de groupes fonctionnels polaires, tels que des groupes carbonyle, dans sa structure.
Q : L’anhydride maléique est-il un diénophile ?
R : Oui, l’anhydride butènedioïque agit comme un diénophile dans les réactions de Diels-Alder, acceptant les diènes pour former des cycloadduits.
Q : À votre avis, quel diène réagirait le plus rapidement avec l’anhydride maléique ?
R : Les diènes ayant une densité électronique accrue, tels que ceux contenant des substituants donneurs d’électrons, devraient réagir plus rapidement avec l’anhydride butènedioïque.
Q : Combien d’esters y a-t-il dans l’anhydride maléique ?
R : L’anhydride butènedioïque ne contient pas d’esters. C’est un anhydride d’acide butènedioïque, qui contient des fonctionnalités ester.
