L’alcool allylique (C3H6O) est un liquide incolore à l’odeur âcre. Il est utilisé dans la production de résines, de plastifiants et de produits pharmaceutiques. Cela peut provoquer une irritation de la peau et des yeux.
| Nom UICPA | Prop-2-en-1-ol |
| Formule moléculaire | C3H6O |
| Numero CAS | 107-18-6 |
| Synonymes | 2-propène-1-ol; Vinylcarbinol ; 2-propénol ; Propylèneol |
| InChI | InChI=1S/C3H6O/c1-2-3-4/h2,4H,1,3H2 |
Propriétés de l’alcool allylique
Formule d’alcool allylique
La formule de l’alcool allylique est C3H6O. Il se compose de trois atomes de carbone (C3), six atomes d’hydrogène (H6) et un atome d’oxygène (O). Cette formule chimique représente la composition et la disposition des atomes dans une molécule d’alcool allylique.
Alcool Allylique Masse molaire
La masse molaire du vinylcarbinol est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le carbone a une masse atomique d’environ 12,01 g/mol, l’hydrogène a une masse atomique d’environ 1,01 g/mol et l’oxygène a une masse atomique d’environ 16,00 g/mol. L’addition de ces valeurs donne la masse molaire du vinylcarbinol d’environ 58,08 g/mol.
Point d’ébullition de l’alcool allylique
Le vinylcarbinol a un point d’ébullition d’environ 97,2 degrés Celsius (207 degrés Fahrenheit). Il s’agit de la température à laquelle la forme liquide du vinylcarbinol passe à l’état gazeux. Le point d’ébullition est influencé par les forces intermoléculaires et la structure moléculaire.
Point de fusion de l’alcool allylique
Le point de fusion du vinylcarbinol est d’environ -129 degrés Celsius (-200 degrés Fahrenheit). C’est la température à laquelle la forme solide du vinylcarbinol se transforme en état liquide. Le point de fusion est déterminé par la force des forces intermoléculaires et la disposition des molécules.
Densité de l’alcool allylique g/mL
La densité du vinylcarbinol est généralement d’environ 0,854 g/mL à 20 degrés Celsius (68 degrés Fahrenheit). La densité est la mesure de la masse par unité de volume, indiquant à quel point les molécules sont serrées dans une substance.
Alcool allylique Poids moléculaire
Le poids moléculaire du vinylcarbinol est d’environ 58,08 grammes par mole (g/mol). Il est calculé en additionnant les poids atomiques de tous les atomes de la molécule en fonction de sa formule chimique.
Structure de l’alcool allylique
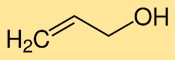
Le vinylcarbinol a une structure moléculaire constituée d’une chaîne à trois carbones (propène) avec un groupe hydroxyle (-OH) attaché à l’un des atomes de carbone. Cet arrangement confère au vinylcarbinol ses propriétés chimiques et sa réactivité uniques.
Solubilité de l’alcool allylique
Le vinylcarbinol est dans une certaine mesure soluble dans l’eau. Il forme des liaisons hydrogène avec les molécules d’eau en raison de la présence du groupe hydroxyle. Cependant, sa solubilité diminue à mesure que la température augmente. Le vinylcarbinol est plus soluble dans les solvants polaires et les solvants organiques tels que l’éthanol et l’acétone.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,854 g/ml |
| Couleur | N / A |
| Odeur | Âcre |
| Masse molaire | 58,08 g/mole |
| Densité | 0,854 g/ml |
| Point de fusion | -129°C (-200°F) |
| Point d’ébullition | 97,2°C (207°F) |
| Point d’éclair | 27,8°C (82°F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans les solvants polaires |
| La pression de vapeur | 22 mmHg à 20°C |
| Densité de vapeur | 2,0 (air = 1) |
| pKa | 15.4 |
| pH | 6,5-8,5 |
Sécurité et dangers de l’alcool allylique
Le vinylcarbinol présente certains risques pour la sécurité et doit être manipulé avec prudence. Il peut provoquer une irritation de la peau, des yeux et du système respiratoire par contact direct ou par inhalation. Une exposition prolongée ou répétée peut entraîner une dermatite. L’ingestion de vinylcarbinol peut entraîner des nausées, des vomissements et des douleurs abdominales. Il est inflammable et peut former des mélanges explosifs avec l’air. Par conséquent, une ventilation adéquate et des mesures de sécurité incendie sont essentielles lors de son stockage et de sa manipulation. Des équipements de protection individuelle, tels que des gants et des lunettes, doivent être utilisés lorsque vous travaillez avec du vinylcarbinol afin de minimiser le risque d’exposition.
| Symboles de danger | Corrosif, Inflammable |
| Description de la sécurité | – Provoque de graves brûlures de la peau et des lésions oculaires – Liquide et vapeurs très inflammables |
| Numéros d’identification de l’ONU | ONU 1098 |
| Code SH | 2905.13.00 |
| Classe de danger | Classe 6.1 (Substances toxiques) <br> Classe 3 (Liquides inflammables) |
| Groupe d’emballage | GE II |
| Toxicité | Toxique en cas d’ingestion, d’inhalation ou d’absorption par la peau. Peut avoir des effets graves sur la santé. |
Méthodes de synthèse de l’alcool allylique
La synthèse du vinylcarbinol implique plusieurs méthodes. Une approche couramment utilisée est l’hydratation catalytique du propylène , où le propylène réagit avec l’eau en présence de catalyseurs d’acide sulfurique ou d’acide phosphorique. Des conditions de température et de pression contrôlées facilitent la formation de vinylcarbinol.
Une autre méthode implique l’hydrolyse du chlorure d’allyle ou de l’acétate d’allyle. Le traitement du chlorure d’allyle avec de l’eau et une base comme l’hydroxyde de sodium ou l’hydroxyde de potassium donne du vinylcarbinol et le sel de chlorure correspondant. De même, l’hydrolyse de l’acétate d’allyle avec de l’eau et une base forte entraîne la production de vinylcarbinol et d’acide acétique.
La déshydrogénation du glycérol, un sous-produit de la production de biodiesel, est une autre voie d’obtention du vinylcarbinol. Le glycérol subit une déshydrogénation catalytique à des températures élevées, produisant du vinylcarbinol.
De plus, la synthèse de Reppe implique la réaction du formaldéhyde avec l’acétylène. Des catalyseurs métalliques tels que le palladium ou le platine sont nécessaires à cette réaction. Le formaldéhyde et l’acétylène réagissent pour générer du vinylcarbinol.
Ces méthodes de synthèse offrent diverses voies de production de vinylcarbinol à l’échelle industrielle afin de répondre à diverses exigences d’application.
Utilisations de l’alcool allylique
- Les fabricants utilisent le vinylcarbinol pour produire des résines, qui ont de nombreuses applications dans la fabrication de revêtements, d’adhésifs et de produits d’étanchéité.
- Les composés pharmaceutiques, y compris les médicaments et les drogues, subissent une synthèse avec le vinylcarbinol servant de précurseur.
- Le vinylcarbinol agit comme un composant clé dans la production de plastifiants, qui améliorent la flexibilité et la durabilité des plastiques.
- Les fabricants utilisent le vinylcarbinol comme élément de base pour produire des éthers allyliques, qui fonctionnent comme solvants et intermédiaires dans la synthèse organique.
- Le vinylcarbinol contribue à la production d’arômes et de parfums synthétiques, qui ajoutent des caractéristiques uniques aux aliments, aux boissons et aux produits de soins personnels.
- Les formulations de polymères bénéficient de l’incorporation de vinylcarbinol comme agent de réticulation, ce qui améliore la résistance mécanique et la résistance à la chaleur.
- Les fabricants produisent des résines allyliques, qui présentent une excellente résistance chimique, pour être utilisées dans la production d’adhésifs, de revêtements et de produits d’étanchéité.
- Le vinylcarbinol sert de matière première pour la synthèse d’esters allyliques, qui trouvent une application dans la préparation de divers produits cosmétiques et de soins personnels.
- Les réactions de chimie organique utilisent le vinylcarbinol comme réactif pour faciliter la synthèse de divers composés.
- Le vinylcarbinol joue un rôle crucial dans la production de produits chimiques spécialisés et d’intermédiaires pour diverses industries, notamment les secteurs pharmaceutique, agricole et chimique.
Des questions:
Q : Quel type de réaction peut être utilisé pour préparer de l’alcool allylique à partir du bromure d’allyle ?
R : Le vinylcarbinol peut être préparé à partir de bromure d’allyle par une réaction de substitution nucléophile utilisant une base forte, telle que l’hydroxyde de sodium ou l’hydroxyde de potassium.
Q : Qu’est-ce qui est inhabituel dans les atomes de carbone allyliques ?
R : Les atomes de carbone allyliques sont adjacents à une double liaison carbone-carbone, ce qui leur confère une réactivité et une stabilité uniques par rapport aux autres atomes de carbone de la molécule.
Q : Qu’est-ce que l’alcool allylique ?
R : L’alcool allylique est un composé alcoolique dans lequel le groupe hydroxyle (-OH) est attaché à un atome de carbone allylique, qui est adjacent à une double liaison carbone-carbone.
Q : Lequel des produits suivants est un alcool allylique ?
R : Le 2-Buten-1-ol est un exemple d’alcool allylique.
Q : Comment former de l’alcool allylique ?
R : Les alcools allyliques peuvent être formés en attachant un groupe hydroxyle à un atome de carbone allylique par le biais de réactions chimiques appropriées, telles que des réactions de substitution ou d’addition nucléophiles.
Q : Que sont les alcools allyliques secondaires ?
R : Les alcools allyliques secondaires sont des alcools allyliques dans lesquels l’atome de carbone allylique est lié à deux autres atomes de carbone et le groupe hydroxyle est attaché à l’un de ces atomes de carbone.
Q : Comment fabriquer de l’alcool allylique ?
R : Les alcools allyliques peuvent être synthétisés en introduisant un groupe hydroxyle dans un atome de carbone allylique via des réactions chimiques appropriées, telles que l’utilisation de nucléophiles ou l’ajout d’eau à des halogénures allyliques ou des oléfines.
Q : Les alcools peuvent-ils être allyliques ?
R : Oui, les alcools peuvent être allyliques si le groupe hydroxyle est attaché à un atome de carbone allylique adjacent à une double liaison carbone-carbone.
Q : L’alcool allylique est-il un alcool primaire ?
R : Non, l’alcool allylique n’est pas un alcool primaire. Il est classé comme alcool secondaire puisque le groupe hydroxyle est attaché à un atome de carbone lié à deux autres atomes de carbone.
