L’éthane est un hydrocarbure de formule chimique C2H6. Il est couramment utilisé comme combustible et constitue un composant du gaz naturel. L’éthane possède deux atomes de carbone et six atomes d’hydrogène.
| Nom UICPA | Éthane |
| Formule moléculaire | C2H6 |
| Numero CAS | 74-84-0 |
| Synonymes | Diéthyle, diméthyle, hydrure d’éthyle, méthylméthane |
| InChI | InChI=1S/C2H6/c1-2/h1-2H3 |
Propriétés de l’éthane
Formule d’éthane
La formule chimique de l’éthane est C2H6. Cela indique que chaque molécule d’éthane est constituée de deux atomes de carbone et de six atomes d’hydrogène. La formule nous aide à comprendre la composition de l’éthane et sa disposition structurelle.
Éthane Masse molaire
La masse molaire de l’hydrure d’éthyle est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le carbone a une masse atomique de 12,01 g/mol et l’hydrogène a une masse atomique de 1,008 g/mol. En multipliant les masses atomiques par leurs comptes respectifs et en les additionnant, on obtient la masse molaire de l’hydrure d’éthyle, qui est d’environ 30,07 g/mol.
Point d’ébullition de l’éthane
L’hydrure d’éthyle a un point d’ébullition de -88,6 degrés Celsius. Cela signifie qu’à pression atmosphérique standard, l’hydrure d’éthyle passera de l’état liquide à l’état gazeux lorsqu’il sera chauffé à cette température. Le point d’ébullition est une propriété importante car elle détermine les conditions dans lesquelles l’hydrure d’éthyle peut être vaporisé.
Éthane Point de fusion
Le point de fusion de l’hydrure d’éthyle est de -182,8 degrés Celsius. À des températures inférieures à ce point, l’hydrure d’éthyle existe sous forme solide. Lorsqu’il est chauffé à cette température ou au-dessus, l’hydrure d’éthyle subit un changement de phase d’un état solide à un état liquide. Le point de fusion est crucial pour comprendre le comportement physique de l’hydrure d’éthyle lors des processus de refroidissement ou de chauffage.
Densité d’éthane g/mL
La densité de l’hydrure d’éthyle est d’environ 0,55 g/mL à température et pression standard. La densité est une mesure de la quantité de masse présente dans un volume donné. Dans le cas de l’hydrure d’éthyle, il nous indique à quel point ses molécules sont serrées et donne un aperçu de ses propriétés physiques.
Éthane Poids moléculaire
Le poids moléculaire de l’hydrure d’éthyle est de 30,07 g/mol. C’est la somme des masses atomiques de tous les atomes d’une seule molécule d’hydrure d’éthyle. Le poids moléculaire nous aide à déterminer la quantité d’hydrure d’éthyle présente dans une masse ou un volume donné.
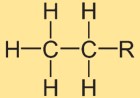
Structure de l’éthane
La structure de l’hydrure d’éthyle est constituée de deux atomes de carbone liés ensemble par une seule liaison covalente. Chaque atome de carbone est entouré de trois atomes d’hydrogène. L’arrangement structurel est linéaire, les atomes d’hydrogène étant positionnés symétriquement autour de la liaison carbone-carbone.
Solubilité de l’éthane
L’hydrure d’éthyle n’est pas très soluble dans l’eau. C’est une molécule apolaire, tandis que l’eau est un solvant polaire. Les molécules non polaires comme l’hydrure d’éthyle ont de faibles forces intermoléculaires et ne se dissolvent pas facilement dans les solvants polaires. Cependant, l’hydrure d’éthyle peut se dissoudre dans d’autres solvants non polaires, tels que l’hexane ou le benzène.
| Apparence | Gaz incolore |
| Gravité spécifique | 1,038 g/L |
| Couleur | N / A |
| Odeur | Inodore |
| Masse molaire | 30,07 g/mole |
| Densité | 0,55 g/ml |
| Point de fusion | -182,8 °C |
| Point d’ébullition | -88,6 °C |
| Point d’éclair | -135 °C |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants non polaires |
| Pression de vapeur | 46,9 psi (à 21 °C) |
| Densité de vapeur | 1,52 (air = 1) |
| pKa | ~50 |
| pH | N / A |
Sécurité et dangers liés à l’éthane
L’hydrure d’éthyle présente plusieurs considérations et dangers en matière de sécurité. Il est hautement inflammable et peut former des mélanges explosifs avec l’air. Lorsqu’il est exposé à une flamme ou à une source de chaleur, l’hydrure d’éthyle peut s’enflammer, provoquant un incendie ou des explosions. Il est important de manipuler et de stocker l’hydrure d’éthyle dans des zones bien ventilées, loin des sources d’inflammation. L’hydrure d’éthyle présente également un risque d’asphyxie, car il déplace l’oxygène dans les espaces clos. L’inhalation de concentrations élevées d’hydrure d’éthyle peut provoquer des étourdissements, des nausées et même une perte de conscience. Il est essentiel d’utiliser un équipement de protection individuelle approprié et de suivre les protocoles de sécurité lorsque vous travaillez avec ou à proximité de l’hydrure d’éthyle afin d’atténuer ces risques.
| Symboles de danger | Gaz inflammable |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes nues. Utiliser dans des zones bien ventilées. Manipuler avec les précautions appropriées pour éviter les risques d’incendie ou d’explosion. |
| Numéros d’identification de l’ONU | UN1035 |
| Code SH | 29011000 |
| Classe de danger | 2.1 (Gaz inflammable) |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | L’éthane n’est pas considéré comme hautement toxique. Cependant, l’inhalation de concentrations élevées peut provoquer une asphyxie. Utiliser avec une ventilation adéquate et éviter une exposition prolongée. |
Méthodes de synthèse de l’éthane
Diverses méthodes synthétisent l’hydrure d’éthyle.
Une méthode courante est le procédé de vapocraquage, dans lequel des températures élevées (environ 750 à 900 °C) chauffent des hydrocarbures, généralement de l’hydrure d’éthyle ou des hydrocarbures plus lourds, en présence de vapeur. Ce processus déclenche des réactions, notamment une décomposition thermique et un réarrangement, produisant de l’hydrure d’éthyle, de l’éthylène et du propylène.
Une autre méthode implique l’hydrogénation catalytique de l’acétylène , où l’acétylène gazeux réagit avec l’hydrogène sur des catalyseurs appropriés comme le palladium ou le nickel, produisant de l’hydrure d’éthyle. Cette méthode convertit sélectivement l’acétylène hautement réactif et potentiellement dangereux en un hydrure d’éthyle plus stable et moins réactif.
L’éthane peut également être obtenu à partir du gaz naturel par extraction cryogénique. Le gaz naturel, principalement l’hydrure de méthyle, est soumis à de basses températures et à des pressions élevées pour séparer et récupérer l’hydrure d’éthyle. Les usines de traitement du gaz naturel utilisent couramment ce procédé pour extraire de l’hydrure d’éthyle précieux pour diverses applications industrielles.
De plus, le raffinage du pétrole et certains procédés pétrochimiques génèrent de l’hydrure d’éthyle comme sous-produit. Des techniques telles que la distillation ou l’absorption séparent l’hydrure d’éthyle des autres flux d’hydrocarbures.
Dans l’ensemble, ces méthodes de synthèse permettent la production d’hydrure d’éthyle, une matière première cruciale pour la fabrication d’une large gamme de produits chimiques, de plastiques et de carburants, contribuant à de nombreuses industries dans le monde.
Utilisations de l’éthane
L’hydrure d’éthyle trouve une application dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations clés de l’hydrure d’éthyle :
- Industrie pétrochimique : l’hydrure d’éthyle est une matière première essentielle pour la production d’éthylène, qui sert de base aux plastiques, aux résines et aux fibres synthétiques. C’est un élément clé dans la fabrication du polyéthylène, l’un des plastiques les plus utilisés au monde.
- Carburant et énergie : L’hydrure d’éthyle joue un rôle dans l’alimentation et l’énergie de processus industriels spécifiques et est un constituant du gaz naturel. Les industries brûlent de l’hydrure d’éthyle pour produire de la chaleur ou de l’électricité, servant ainsi de source d’énergie pour les applications résidentielles, commerciales et industrielles.
- Réfrigération : dans certaines applications, telles que les systèmes à basse température, l’hydrure d’éthyle sert de réfrigérant, offrant des capacités de refroidissement efficaces. Il offre des capacités de refroidissement efficaces et constitue une alternative aux autres réfrigérants ayant un impact environnemental plus élevé.
- Solvant : L’hydrure d’éthyle sert de solvant non polaire, en particulier en laboratoire. L’hydrure d’éthyle facilite les processus tels que l’extraction, la purification et l’analyse.
- Gaz d’étalonnage : l’hydrure d’éthyle sert de composant dans l’étalonnage des mélanges de gaz pour les détecteurs et analyseurs de gaz, permettant l’étalonnage et la vérification des équipements de détection de gaz.
- Propulseur d’aérosol : L’hydrure d’éthyle fonctionne comme un propulseur d’aérosol dans divers produits, expulsant leur contenu du récipient lors du relâchement de la pression. Il confère la force requise pour pulvériser des substances telles que des cosmétiques, des peintures et des produits ménagers.
- Synthèse chimique : l’hydrure d’éthyle sert de matière première pour la synthèse d’une variété de produits chimiques organiques, notamment l’éthanol, l’oxyde d’éthylène et le chlorure de vinyle. Ces produits chimiques trouvent des applications dans la production de solvants, de plastiques, de détergents et de tuyaux en PVC, entre autres.
Ces diverses applications mettent en évidence l’importance de l’hydrure d’éthyle dans de multiples industries, ce qui en fait un élément crucial dans la fabrication moderne et dans la vie quotidienne.
Des questions:
Q : Le C2H6 est-il polaire ou non polaire ?
R : C2H6 (hydrure d’éthyle) est une molécule non polaire car la différence d’électronégativité entre le carbone et l’hydrogène est faible, ce qui entraîne une répartition uniforme de la densité électronique.
Q : Combien de moles d’atomes de carbone y a-t-il dans 0,500 mole de C2H6 ?
R : Dans 0,500 mole de C2H6, il y a 1,00 mole d’atomes de carbone puisque chaque molécule de C2H6 contient 2 atomes de carbone.
Q : Quelle est la formule empirique du C2H6 ?
R : La formule empirique du C2H6 est CH3, ce qui représente le rapport le plus simple des atomes présents dans la molécule.
Q : Qu’est-ce que le C2H6 ?
R : C2H6 est la formule chimique de l’hydrure d’éthyle, un hydrocarbure gazeux couramment utilisé comme carburant et composant du gaz naturel.
Q : Pourquoi l’éthane (C2H6) n’a-t-il pas d’isomères structuraux ?
R : L’hydrure d’éthyle (C2H6) n’a pas d’isomères structuraux car ses atomes de carbone sont reliés par une simple liaison, ce qui donne une structure linéaire sans autre arrangement possible.
Q : C2H6 a-t-il une liaison hydrogène ?
R : C2H6 (hydrure d’éthyle) n’a pas de liaison hydrogène car il lui manque des atomes d’hydrogène liés à des éléments hautement électronégatifs comme l’azote, l’oxygène ou le fluor.
Q : Le C2H6 est-il ionique ou covalent ?
R : C2H6 est un composé covalent car il est formé par le partage d’électrons entre des atomes de carbone et d’hydrogène.
Q : Le C2H6 est-il soluble dans l’eau ?
R : C2H6 est insoluble dans l’eau car il s’agit d’une molécule non polaire et ne se dissout pas facilement dans le solvant polaire.
Q : Un mélange gazeux contient-il du CH4 et du C2H6 en proportion équimolaire ?
R : Oui, si le mélange gazeux contient du CH4 et du C2H6 en proportion équimolaire, cela signifie que le nombre de moles de CH4 est égal au nombre de moles de C2H6 dans le mélange.
