L’isobutanol est un liquide incolore à forte odeur. Il est utilisé comme solvant, additif pour carburant et dans la production de divers produits chimiques. Il peut provoquer une irritation en cas d’inhalation ou de contact avec la peau.
| Nom UICPA | 2-méthylpropan-1-ol |
| Formule moléculaire | C4H10O |
| Numero CAS | 78-83-1 |
| Synonymes | Alcool isobutylique, 2-méthyl-1-propanol, alcool 2-méthylpropylique |
| InChI | InChI=1S/C4H10O/c1-4(2)3-5/h4-5H,3H2,1-2H3 |
Propriétés de l’isobutanol
Formule isobutanol
La formule de l’alcool isobutylique est C4H10O. Il se compose de quatre atomes de carbone, dix atomes d’hydrogène et un atome d’oxygène. C’est un composé alcoolique également connu sous le nom de 2-méthylpropan-1-ol.
Isobutanol Masse molaire
La masse molaire de l’alcool isobutylique est calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour l’alcool isobutylique, la masse molaire est d’environ 74,12 grammes par mole.
Point d’ébullition de l’isobutanol
L’alcool isobutylique a un point d’ébullition d’environ 107,89 degrés Celsius (225,2 degrés Fahrenheit). Cela signifie qu’à cette température, l’alcool isobutylique passe de l’état liquide à l’état gazeux.
Isobutanol Point de fusion
Le point de fusion de l’alcool isobutylique est d’environ -108 degrés Celsius (-162,4 degrés Fahrenheit). C’est la température à laquelle l’alcool isobutylique passe de l’état solide à l’état liquide.
Isobutanol Densité g/mL
L’alcool isobutylique a une densité d’environ 0,806 gramme par millilitre. Cette densité indique la masse d’alcool isobutylique par unité de volume et permet de déterminer son comportement dans diverses applications.
Isobutanol Poids moléculaire
Le poids moléculaire de l’alcool isobutylique, qui est la somme des poids atomiques de ses atomes constitutifs, est d’environ 74,12 grammes par mole. C’est un facteur important dans divers calculs et réactions chimiques.
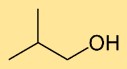
Structure de l’isobutanol
La structure de l’alcool isobutylique est constituée d’un atome de carbone central lié à trois autres atomes de carbone et d’un groupe hydroxyle (-OH). Il a une structure ramifiée avec le groupe méthyle (CH3) attaché au deuxième atome de carbone.
Solubilité de l’isobutanol
L’alcool isobutylique est miscible avec de nombreux solvants organiques, notamment l’eau, l’éthanol et l’éther diéthylique. Cependant, sa solubilité dans l’eau est relativement faible. La solubilité de l’alcool isobutylique dépend de facteurs tels que la température et la polarité du solvant.
| Propriété | Valeur |
| Apparence | Liquide incolore |
| Gravité spécifique | 0,806 |
| Couleur | N / A |
| Odeur | Fort |
| Masse molaire | 74,12 g/mole |
| Densité | 0,806 g/ml |
| Point de fusion | -108 °C |
| Point d’ébullition | 107,89 °C |
| Point d’éclair | 35 °C |
| Solubilité dans l’eau | Miscible |
| Solubilité | Miscible avec les solvants organiques, notamment l’eau, l’éthanol et l’éther diéthylique |
| Pression de vapeur | 7,49 mmHg à 25 °C |
| Densité de vapeur | 2,55 (air = 1) |
| pKa | 16h18 |
| pH | 7 (neutre) |
Sécurité et dangers de l’isobutanol
L’alcool isobutylique présente certains risques pour la sécurité qui doivent être pris en compte. Il peut provoquer une irritation en cas d’inhalation, d’ingestion ou de contact avec la peau ou les yeux. Une ventilation adéquate et un équipement de protection individuelle doivent être utilisés lors de la manipulation de ce produit chimique. L’alcool isobutylique est inflammable et peut former des mélanges vapeur-air explosifs. Son point d’éclair est bas, à 35 degrés Celsius, ce qui en fait un risque potentiel d’incendie. Des précautions doivent être prises pour éviter les sources d’inflammation. En cas de rejet accidentel, des procédures appropriées de confinement et de nettoyage doivent être suivies. Il est important de se référer aux fiches de données de sécurité et de suivre les protocoles de sécurité appropriés lorsque vous travaillez avec de l’alcool isobutylique.
| Symboles de danger | Inflammable, Irritant |
| Description de la sécurité | Tenir à l’écart des sources d’inflammation. Utiliser dans un endroit bien ventilé. Évitez tout contact direct avec la peau et les yeux. |
| Numéros d’identification de l’ONU | ONU 1212 |
| Code SH | 2905.13.00 |
| Classe de danger | Classe 3 – Liquides inflammables |
| Groupe d’emballage | GE II |
| Toxicité | Peut provoquer des irritations. Peut être nocif en cas d’ingestion. |
Méthodes de synthèse de l’isobutanol
Diverses méthodes permettent de synthétiser l’alcool isobutylique. Une méthode courante consiste à hydrogéner catalytiquement l’isobutyraldéhyde en le mélangeant avec de l’hydrogène gazeux en présence d’un catalyseur métallique, tel que le nickel ou le platine. Le catalyseur facilite la conversion de l’isobutyraldéhyde en alcool isobutylique.
Une autre méthode consiste à hydroformyler le propylène , dans lequel le propylène réagit avec le monoxyde de carbone et l’hydrogène gazeux à l’aide d’un catalyseur, généralement un complexe à base de rhodium. Cette réaction génère de l’isobutyraldéhyde, qui peut ensuite subir une hydrogénation supplémentaire pour donner de l’alcool isobutylique.
Le processus de fermentation de la biomasse permet la production d’alcool isobutylique. Certains micro-organismes, notamment les bactéries et les levures, peuvent métaboliser les sucres ou d’autres sources de carbone et produire de l’alcool isobutylique comme sous-produit. Cette méthode biosourcée présente une approche renouvelable et durable de la production d’alcool isobutylique.
L’hydratation indirecte de l’isobutène est une méthode utilisée pour synthétiser l’alcool isobutylique. Cela implique la réaction de l’isobutène avec de l’acide sulfurique pour former de l’alcool tert-butylique (TBA), qui peut ensuite subir une déshydratation pour générer de l’alcool isobutylique.
Chacune de ces méthodes présente ses avantages et ses considérations en termes de coût, d’efficacité et d’impact environnemental. Le choix de la méthode de synthèse dépend de facteurs tels que la pureté souhaitée de l’alcool isobutylique, la disponibilité des matières premières et les exigences industrielles spécifiques.
Utilisations de l’isobutanol
L’alcool isobutylique trouve des applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations courantes de l’alcool isobutylique :
Solvant : L’alcool isobutylique dissout et disperse activement d’autres substances, améliorant ainsi leur application et leurs performances dans diverses applications telles que les peintures, les revêtements et les résines.
Additif pour carburant : L’alcool isobutylique améliore activement l’indice d’octane et améliore l’efficacité de combustion de l’essence lorsqu’il est mélangé comme additif pour carburant. Il sert activement d’alternative renouvelable aux additifs d’essence conventionnels.
Intermédiaire chimique : L’alcool isobutylique joue activement un rôle clé en tant qu’intermédiaire dans la production de divers produits chimiques. Elle participe activement à la fabrication d’esters, de plastifiants, d’herbicides et de produits pharmaceutiques.
Agent d’extraction : L’alcool isobutylique extrait et concentre activement les composés aromatiques, servant d’agent d’extraction dans la production d’arômes et de parfums naturels et synthétiques.
Encres d’imprimerie : l’alcool isobutylique contribue activement à la dissolution des pigments et à l’amélioration du débit d’encre dans la formulation des encres d’imprimerie, en particulier dans les procédés d’impression flexographique et hélio.
Produits de soins personnels : l’alcool isobutylique agit activement comme solvant pour les ingrédients de parfum dans la formulation de produits de soins personnels tels que les parfums, les eaux de Cologne et les lotions. Il contribue activement à l’obtention des profils olfactifs souhaités.
Produits pharmaceutiques : l’alcool isobutylique sert activement de solvant ou de milieu réactionnel dans les processus de fabrication pharmaceutique, permettant la synthèse et la formulation de divers médicaments.
Ces diverses applications mettent en évidence l’importance de l’alcool isobutylique dans de multiples industries, ce qui en fait un composé précieux doté d’un large éventail d’utilisations.
Des questions:
Q : Qu’est-ce que l’isobutanol ?
R : L’alcool isobutylique est un alcool liquide incolore avec une forte odeur, couramment utilisé comme solvant, additif pour carburant et intermédiaire chimique dans diverses industries.
Q : L’isobutanol est-il soluble dans l’eau ?
R : L’alcool isobutylique est partiellement soluble dans l’eau, avec une miscibilité limitée en raison de sa nature hydrophobe.
Q : À quels déplacements chimiques (ppm) prévoyons-nous d’observer les 4 pics d’isobutanol ?
R : Les quatre pics d’alcool isobutylique sont généralement observés lors de déplacements chimiques d’environ 0,9 ppm (singulet), 1,1 à 1,3 ppm (quartet), 1,6 à 1,8 ppm (multiplet) et 3,7 à 4,0 ppm (multiplet).
Q : Comment produire de l’isobutanol ?
R : L’alcool isobutylique peut être produit par diverses méthodes, notamment l’hydrogénation catalytique de l’isobutyraldéhyde, l’hydroformylation du propylène, la fermentation de la biomasse ou l’hydratation indirecte de l’isobutène.
Q : Dans quoi l’isobutanol est-il utilisé ?
R : L’alcool isobutylique est utilisé comme solvant, additif pour carburant, intermédiaire chimique, agent d’extraction, composant d’encre d’imprimerie et dans les produits de soins personnels et pharmaceutiques.
Q : Dans quelle mesure l’isobutanol est-il soluble ?
R : L’alcool isobutylique présente une solubilité modérée dans l’eau, mais il est hautement soluble dans les solvants organiques tels que l’éthanol et l’éther diéthylique.
Q : L’isobutanol est-il un peroxyde ?
R : Non, l’alcool isobutylique n’est pas considéré comme un agent peroxyde, contrairement à certains autres composés organiques qui peuvent former des peroxydes explosifs lors d’une exposition à l’air et à la lumière.
Q : Quel avantage la production directe d’isobutanol par des cyanobactéries artificielles présente-t-elle par rapport à d’autres biocarburants alternatifs ?
R : La production directe d’alcool isobutylique par des cyanobactéries modifiées offre des avantages tels qu’un rendement élevé, la neutralité carbone et le potentiel de production de biocarburants renouvelables et durables.
