L’acide butyrique ou acide butanoïque est un acide gras à chaîne courte que l’on trouve couramment dans les produits laitiers et certains aliments végétaux. Il a une odeur âcre et rance et est utilisé comme ingrédient aromatisant et parfumant dans l’industrie alimentaire. Il présente également des avantages potentiels pour la santé, notamment des propriétés anti-inflammatoires et anticancéreuses.
| Nom UICPA | Acide butanoïque |
| Formule moléculaire | C4H8O2 |
| Numero CAS | 107-92-6 |
| Synonymes | Acide n-butanoïque, Anhydride butyrique, Acide éthylacétique, Anhydride éthylacétique |
| InChI | InChI=1S/C4H8O2/c1-3-2-4(5)6/h3-4H,2H2,1H3,(H,5,6) |
Butyrate
Le butyrate est un sel ou un ester de l’acide butanoïque. C’est un anion de formule chimique C4H7O2-, formé par la réaction de l’acide butyrique avec une base. Le butyrate est couramment utilisé dans diverses applications, telles que comme additif alimentaire dans la nutrition animale, comme plastifiant dans la fabrication de plastiques et comme ingrédient dans certains produits de soins personnels et cosmétiques. Dans le domaine médical, le butyrate s’est révélé doté de propriétés anti-inflammatoires et anticancéreuses potentielles et est étudié pour son utilisation potentielle dans le traitement de certaines maladies.
Propriétés de l’acide butyrique
Point d’ébullition de l’acide butyrique :
Le point d’ébullition de l’acide butyrique est de 163°C. À cette température, la pression de vapeur du liquide est égale à la pression atmosphérique, ce qui lui permet de bouillir et de se transformer en gaz. Ce point d’ébullition est relativement bas par rapport à d’autres composés organiques et est important pour son utilisation dans diverses applications industrielles.
Densité de l’acide butyrique g/ml :
La densité de l’acide butyrique est d’environ 1,05 g/ml. Il s’agit d’une densité relativement faible par rapport à d’autres acides organiques, et sa faible densité affecte ses propriétés physiques, telles que sa capacité à se mélanger avec d’autres liquides. La densité de l’acide butyrique est un facteur important à prendre en compte lors de son utilisation dans des applications industrielles.
Poids moléculaire de l’acide butyrique :
Le poids moléculaire de l’acide butyrique est de 88,11 g/mol. C’est la somme des poids atomiques des éléments de sa formule moléculaire (C4H8O2). Le poids moléculaire est un facteur important pour déterminer de nombreuses propriétés physiques et chimiques de l’acide butyrique, notamment ses points d’ébullition et de fusion, sa densité et sa solubilité.
Masse molaire de l’acide butyrique :
La masse molaire de l’acide butanoïque est de 88,11 g/mol. C’est un acide organique à chaîne à quatre carbones, qui contient 8 atomes d’hydrogène, 2 atomes d’oxygène et 4 atomes de carbone. Cette combinaison d’éléments confère à l’acide butyrique son poids moléculaire distinct, qui est important pour bon nombre de ses propriétés physiques et chimiques.
Point de fusion de l’acide butyrique :
Le point de fusion de l’acide butanoïque est de -14°C. Cela signifie qu’il passera d’un solide à un liquide à cette température, ce qui en fera un acide organique à point de fusion relativement bas. Ce bas point de fusion est une caractéristique clé de l’acide butyrique et affecte ses propriétés physiques, telles que la viscosité et la solubilité.
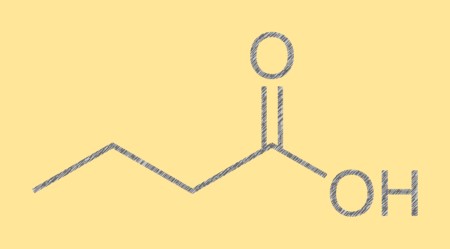
Structure de l’acide butyrique :
L’acide butanoïque a une chaîne carbonée linéaire avec un groupe carboxyle (-COOH) à une extrémité. Ce groupe carboxyle confère à l’acide butyrique ses propriétés acides caractéristiques et est responsable de sa forte odeur. La structure moléculaire de l’acide butanoïque est importante pour déterminer ses propriétés physiques et chimiques, ainsi que sa réactivité avec d’autres composés.
Formule d’acide butyrique :
La formule chimique de l’acide butanoïque est C4H8O2. Cette formule représente le nombre d’atomes de chaque élément de la molécule. Les quatre atomes de carbone sont reliés par une chaîne droite, avec un atome d’oxygène et un groupe hydroxyle (-OH) à une extrémité et un groupe carboxyle (-COOH) à l’autre extrémité.
RMN de l’acide butyrique :
La spectroscopie par résonance magnétique nucléaire (RMN) est une technique analytique puissante utilisée pour déterminer la structure de molécules organiques comme l’acide butanoïque. Les spectres RMN fournissent des informations sur l’environnement chimique des atomes de la molécule, notamment les types de liaisons présentes, leur disposition et l’orientation de la molécule. Ces informations sont importantes pour comprendre la réactivité et les propriétés physiques de l’acide butyrique.
| Apparence | Liquide clair, incolore à jaune |
| Gravité spécifique | 1,05 g/ml |
| Couleur | Clair, incolore à jaune |
| Odeur | Odeur forte, piquante et rance |
| Masse molaire | 88,11 g/mole |
| Densité | 1,05 g/ml |
| Point de fusion | -14°C |
| Point d’ébullition | 163°C |
| Point d’éclair | 85°C |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’éthanol, l’éther et d’autres solvants organiques |
| La pression de vapeur | 0,04 mmHg (à 20°C) |
| Densité de vapeur | 1,04 (air = 1) |
| pKa | 4,83 |
| pH | 3,5-5,5 |
Sécurité et dangers de l’acide butyrique
L’acide butyrique est considéré comme une matière dangereuse en raison de son odeur forte et âcre et de ses propriétés corrosives. L’inhalation de vapeurs ou de brouillards d’acide butyrique peut provoquer une irritation des yeux, du nez et du système respiratoire, ainsi que des maux de tête, des étourdissements et des nausées. De plus, l’acide butanoïque peut provoquer une irritation de la peau et des yeux et peut être nocif en cas d’ingestion. Il est important de manipuler l’acide butyrique avec prudence et de porter des vêtements de protection, tels que des gants et des lunettes, lorsque vous travaillez avec. Il doit également être stocké dans un endroit bien ventilé et éloigné des sources de chaleur pour éviter le dégagement de vapeurs dangereuses. En cas de contact avec la peau ou les yeux, rincer abondamment à l’eau et consulter un médecin si nécessaire. En cas d’ingestion, ne pas faire vomir et consulter immédiatement un médecin.
| Symboles de danger | Corrosif, Irritant |
| Description de la sécurité | S26-S36/37/39-S45 |
| Numéros d’identification de l’ONU | UN3265 |
| Code SH | 2915.90.90 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | III |
| Toxicité | DL50 orale : 710 mg/kg (rat)<br>CL50 par inhalation : non disponible<br>Irritation cutanée : légèrement irritante<br>Irritation oculaire : modérément irritante |
Méthodes de synthèse de l’acide butyrique
L’acide butanoïque (C4H8O2) peut être synthétisé par diverses méthodes, notamment des processus biologiques, chimiques et enzymatiques.
La synthèse biologique de l’acide butanoïque implique la fermentation des glucides par des bactéries, telles que Clostridium acetobutylicum, en l’absence d’oxygène. Ce processus produit un mélange d’acides butyrique, acétique et propionique, appelé acide solvantogène.
La synthèse chimique de l’acide butanoïque peut être réalisée par oxydation du butanol ou par hydrolyse d’esters, comme le butyrate d’éthyle.
La synthèse enzymatique de l’acide butanoïque est réalisée à l’aide d’une enzyme lipase pour catalyser l’estérification du butanol et de l’acide acétique.
Quelle que soit la méthode de synthèse, l’acide butanoïque est souvent purifié par des techniques de distillation ou d’extraction pour obtenir le produit pur.
Il est important de noter que le choix de la méthode de synthèse peut affecter la qualité, le rendement et le coût du produit final. Il est donc important de considérer attentivement les besoins et exigences spécifiques de chaque application lors de la sélection d’une méthode de synthèse de l’acide butanoïque. .
Utilisations de l’acide butyrique
Le beurre, le fromage et d’autres produits laitiers contiennent de l’acide butanoïque, qui est couramment utilisé comme agent aromatisant dans les produits alimentaires et dans la fabrication de plastiques, de solvants et d’autres produits chimiques industriels.
Les chercheurs ont également utilisé l’acide butanoïque pour traiter les troubles gastro-intestinaux tels que le syndrome du côlon irritable, la maladie de Crohn et la colite ulcéreuse, car il réduit l’inflammation, améliore la santé intestinale et favorise la guérison.
De plus, l’acide butanoïque possède des propriétés antifongiques et peut inhiber la croissance des cellules cancéreuses et induire l’apoptose de certains types de cellules cancéreuses.
En outre, certaines études ont suggéré que l’acide butanoïque pourrait protéger les neurones des dommages causés par des maladies neurodégénératives telles que la maladie de Parkinson et la maladie d’Alzheimer. Enfin, l’acide butanoïque est souvent utilisé comme conservateur dans les produits alimentaires, car il inhibe la croissance des bactéries, champignons et autres micro-organismes.
Des questions:
Qu’est-ce que l’acide butyrique ?
L’acide butanoïque est un acide gras à chaîne courte de formule moléculaire CH3CH2CH2COOH. C’est un liquide incolore et soluble dans l’eau avec une odeur forte et piquante et est naturellement présent dans les produits laitiers, comme le fromage et le beurre, ainsi que dans certaines huiles végétales. L’acide butanoïque est utilisé dans diverses applications, notamment comme ingrédient d’arôme et de parfum, comme intermédiaire chimique et comme additif alimentaire dans l’alimentation animale. Il présente également un intérêt dans le domaine médical en raison de ses potentielles propriétés anti-inflammatoires et anticancéreuses.
Comment fabriquer de l’acide butyrique ?
L’acide butanoïque peut être synthétisé par des processus biologiques, tels que la fermentation des glucides par des bactéries, ainsi que par des processus chimiques et enzymatiques, tels que l’oxydation du butanol ou l’estérification du butanol et de l’acide acétique à l’aide d’une enzyme lipase. La méthode de synthèse utilisée peut affecter la qualité, le rendement et le coût du produit final.
Complétez la réaction acido-basique entre l’acide butyrique hc4h7o2 et l’hydroxyde de potassium koh.
La réaction entre l’acide butanoïque (HC4H7O2) et l’hydroxyde de potassium (KOH) peut être représentée comme suit :
HC4H7O2 + KOH → KC4H7O2 + H2O
Dans cette réaction, l’acide butanoïque (HC4H7O2) agit comme un acide et cède un proton (H+) à l’hydroxyde de potassium (KOH), qui agit comme une base et accepte le proton. Il en résulte la formation de butyrate de potassium (KC4H7O2) et d’eau (H2O). Cette réaction peut être classée comme réaction de neutralisation, car elle entraîne la neutralisation de l’acide butanoïque acide et de l’hydroxyde de potassium basique pour former un sel neutre.
Acide indole-3-butyrique ?
L’acide indole-3-butyrique (IBA) est un régulateur de croissance des plantes et un type d’auxine couramment utilisé en horticulture pour stimuler la formation des racines et la croissance d’une variété d’espèces végétales. Les horticulteurs trempent les extrémités coupées dans une solution d’IBA dissoute dans l’eau ou appliquent la solution sous forme de pulvérisation foliaire pour propager et enraciner des boutures d’arbres à feuilles caduques et à feuilles persistantes, d’arbustes et de plantes herbacées pour la production de plantes ornementales, d’arbres fruitiers, d’arbres forestiers, de légumes. et les cultures florales. Cependant, il faut surveiller attentivement l’utilisation d’IBA pour éviter une application excessive et des dommages potentiels à la plante ou à l’environnement.
