L’acétate d’ammonium est un composé utilisé dans diverses industries. Il agit comme une source d’ions acétate et joue un rôle dans les réactions chimiques et la synthèse organique.
| Nom UICPA | Acétate d’ammonium |
| Formule moléculaire | C2H7NO2 |
| Numero CAS | 631-61-8 |
| Synonymes | Sel d’ammonium de l’acide acétique, éthanoate d’ammonium, acide acétique d’ammonium, acide acétique, sel d’ammonium |
| InChI | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Propriétés de l’acétate d’ammonium
Formule d’acétate d’ammonium
La formule du sel d’ammonium de l’acide acétique est C2H7NO2. Il se compose de deux atomes de carbone, sept atomes d’hydrogène, un atome d’azote et deux atomes d’oxygène.
Acétate D’Ammonium Masse molaire
La masse molaire du sel d’ammonium de l’acide acétique est calculée en additionnant les masses atomiques de ses éléments constitutifs. C’est environ 77,0825 grammes par mole.
Point d’ébullition de l’acétate d’ammonium
Le sel d’ammonium de l’acide acétique a un point d’ébullition d’environ 117 degrés Celsius. A cette température, le composé subit un changement de phase de liquide à gaz.
Acétate d’ammonium Point de fusion
Le point de fusion du sel d’ammonium de l’acide acétique est d’environ 114 degrés Celsius. C’est la température à laquelle le composé solide passe à l’état liquide.
Densité d’acétate d’ammonium g/mL
La densité du sel d’ammonium de l’acide acétique est d’environ 1,17 gramme par millilitre. C’est une mesure de la masse par unité de volume du composé.
Ammonium Acétate Poids moléculaire
Le poids moléculaire du sel d’ammonium de l’acide acétique est d’environ 77,0825 grammes par mole. C’est la somme des poids atomiques de tous les atomes présents dans le composé.
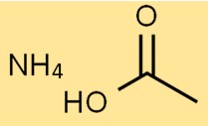
Structure de l’acétate d’ammonium
La structure du sel d’ammonium de l’acide acétique est constituée d’un ion NH4+ et d’un ion CH3COO-. L’ion NH4+ est chargé positivement, tandis que l’ion CH3COO- est chargé négativement.
Solubilité de l’acétate d’ammonium
Le sel d’ammonium de l’acide acétique est hautement soluble dans l’eau. Il se dissout facilement dans l’eau pour former une solution claire et incolore. La solubilité du sel d’ammonium de l’acide acétique dans l’eau est due à sa capacité à former des liaisons hydrogène avec les molécules d’eau.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,17 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 77,0825 g/mole |
| Densité | 1,17 g/ml |
| Point de fusion | 114 °C |
| Point d’ébullition | 117 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | très soluble dans l’eau |
| Solubilité | Soluble dans l’eau, l’acide acétique, l’éthanol |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | 4,75 |
| pH | Environ 6,0-7,0 |
Sécurité et dangers de l’acétate d’ammonium
Le sel d’ammonium de l’acide acétique présente des risques minimes pour la sécurité lorsqu’il est manipulé correctement. Son utilisation est généralement considérée comme sûre dans diverses applications. Cependant, comme pour tout produit chimique, des précautions doivent être prises. Évitez l’inhalation de poussières ou de vapeurs, car cela pourrait provoquer une irritation des voies respiratoires. Il est conseillé de porter un équipement de protection individuelle approprié, notamment des gants et des lunettes de sécurité, lorsque vous travaillez avec du sel d’ammonium d’acide acétique. En cas d’ingestion accidentelle ou de contact avec les yeux ou la peau, rincer abondamment à l’eau et consulter un médecin si nécessaire. Conservez le sel d’ammonium de l’acide acétique dans un endroit frais et sec, à l’écart des substances incompatibles. Suivez les procédures de manipulation et d’élimination appropriées pour garantir la sécurité.
| Symboles de danger | Aucun |
| Description de la sécurité | Faible toxicité |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2915.29.10 |
| Classe de danger | Le sel d’ammonium de l’acide acétique n’est pas classé |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’acétate d’ammonium
Il existe plusieurs méthodes pour synthétiser le sel d’ammonium de l’acide acétique. Une approche courante consiste à mélanger de l’acide acétique avec une solution aqueuse de carbonate d’ammonium . La réaction entre eux produit du sel d’ammonium et de l’eau acétique. Cette méthode nécessite de contrôler la température et la pression pendant la réaction.
Dans une autre méthode, les chimistes ajoutent progressivement de l’acide acétique à une solution d’ammoniaque tout en remuant jusqu’à ce que le pH souhaité soit atteint. Ce processus de neutralisation convertit l’ acide acétique en sel d’ammonium de l’acide acétique. Un mélange soigneux et un contrôle du pH sont essentiels au cours de cette réaction.
Utilisez de l’hydroxyde d’ammonium pour synthétiser le sel d’ammonium de l’acide acétique en le combinant avec de l’acide acétique , ce qui entraîne la formation de sel d’ammonium de l’acide acétique et d’eau. Surveillez la progression de cette réaction jusqu’à ce qu’elle soit terminée.
Mélangez l’anhydride acétique avec de l’hydroxyde d’ammonium ou de l’ammoniaque pour préparer le sel d’ammonium de l’acide acétique. La réaction entre ces réactifs entraîne la formation d’un sel d’ammonium de l’acide acétique.
N’oubliez pas qu’il est essentiel d’effectuer la synthèse du sel d’ammonium de l’acide acétique dans un endroit bien ventilé et de respecter les mesures de sécurité appropriées. Tout au long du processus de synthèse, assurer la manipulation et le stockage appropriés des produits chimiques.
Utilisations de l’acétate d’ammonium
Le sel d’ammonium de l’acide acétique trouve diverses applications dans différentes industries en raison de ses propriétés polyvalentes. Voici quelques utilisations courantes :
- Le sel d’ammonium de l’acide acétique tamponne les solutions et maintient un niveau de pH stable dans les laboratoires chimiques et biologiques.
- Les méthodes analytiques telles que la chromatographie et la spectrométrie de masse utilisent le sel d’ammonium de l’acide acétique comme réactif pour l’ionisation et la séparation des composés.
- La biologie moléculaire utilise le sel d’ammonium de l’acide acétique pour précipiter l’ADN lors des procédures de purification, éliminant ainsi les contaminants et les impuretés.
- Le sel d’ammonium de l’acide acétique participe à de nombreuses réactions chimiques, agissant comme source d’ions acétate dans la synthèse organique, les réactions d’estérification et les processus catalytiques.
- En agriculture, le sel d’ammonium de l’acide acétique sert de source d’azote dans les engrais, favorisant la croissance et le développement des plantes.
- Les industries textiles utilisent le sel d’ammonium de l’acide acétique pour teindre et imprimer les tissus, améliorant ainsi la solidité des couleurs en fixant les colorants sur le tissu.
- L’industrie alimentaire approuve le sel d’ammonium de l’acide acétique comme additif alimentaire, régulant l’acidité pour contrôler le pH de divers produits alimentaires.
- Dans les techniques d’analyse chimique telles que la HPLC (chromatographie liquide haute performance), le sel d’ammonium de l’acide acétique facilite la séparation et la détection des composés.
Dans l’ensemble, le sel d’ammonium de l’acide acétique est un composé polyvalent dont les utilisations vont des applications en laboratoire à l’agriculture et à l’industrie alimentaire. Ses propriétés uniques en font un ingrédient important dans divers processus et produits.
Des questions:
Q : Combien d’atomes d’hydrogène y a-t-il dans une molécule d’acétate d’ammonium, NH4C2H3O2 ?
R : Il y a quatre atomes d’hydrogène dans une molécule de sel d’ammonium de l’acide acétique (NH4C2H3O2).
Q : L’acétate d’ammonium est-il soluble ?
R : Oui, le sel d’ammonium de l’acide acétique est soluble dans l’eau.
Q : Quelle est la formule de l’acétate d’ammonium ?
R : La formule du sel d’ammonium de l’acide acétique est NH4C2H3O2.
Q : L’acétate d’ammonium est-il soluble dans l’eau ?
R : Oui, le sel d’ammonium de l’acide acétique est soluble dans l’eau.
Q : Comment préparer de l’acétate d’ammonium 1 M ?
R : Pour préparer du sel d’ammonium d’acide acétique 1 M, dissolvez la quantité appropriée d’acétate d’ammonium dans l’eau pour obtenir une concentration de 1 mole par litre (M).
Q : Combien de moles d’ions au total sont libérées lorsque 0,624 mole d’acétate d’ammonium sont dissoutes dans l’eau ?
R : Lorsque 0,624 moles de sel d’ammonium de l’acide acétique sont dissoutes dans l’eau, un total de 1,248 moles d’ions (NH4+ et C2H3O2-) sont libérées.
Q : Quel est le poids moléculaire exact de l’acétate d’ammonium (NH4OAc) ?
R : Le poids moléculaire exact du sel d’ammonium de l’acide acétique (NH4OAc) est d’environ 77,0825 grammes par mole.
Q : Comment fabriquer de l’acétate d’ammonium 5 M ?
R : Pour préparer du sel d’ammonium d’acide acétique 5 M, dissolvez la quantité appropriée d’acétate d’ammonium dans l’eau pour atteindre une concentration de 5 moles par litre (M).
Q : Quel est le pKa de l’acide acétique et le pKb de l’hydroxyde d’ammonium ?
R : Le pKa de l’acide acétique est d’environ 4,75 et le pKb du sel d’ammonium de l’acide acétique est d’environ 4,25.
