L’hydrure de lithium et d’aluminium (LiAlH4) est un puissant agent réducteur utilisé en chimie organique pour convertir les composés carbonylés en alcools. Il réagit vigoureusement avec l’eau.
| Nom UICPA | Hydrure de lithium et d’aluminium |
| Formule moléculaire | LiAlH4 |
| Numero CAS | 16853-85-3 |
| Synonymes | Tétrahydridoaluminate de lithium (III), hydrure de lithium d’aluminium (III) |
| InChI | InChI=1S/Al.Li.4H |
Propriétés de l’hydrure de lithium et d’aluminium (LiAlH4)
Formule d’hydrure de lithium et d’aluminium (LiAlH4)
La formule du tétrahydridoaluminate de lithium (LiAlH4) représente sa composition. Il se compose d’un atome de lithium (Li), d’un atome d’aluminium (Al) et de quatre atomes d’hydrogène (H). La formule s’écrit LiAlH4, indiquant la présence de ces éléments.
Hydrure De Lithium-Aluminium (LiAlH4) Masse molaire
La masse molaire du tétrahydridoaluminate de lithium (LiAlH4) est la somme des masses atomiques de ses éléments constitutifs. Il est calculé comme suit :
- Le lithium (Li) a une masse molaire d’environ 6,94 g/mol.
- L’aluminium (Al) a une masse molaire d’environ 26,98 g/mol.
- L’hydrogène (H) a une masse molaire d’environ 1,01 g/mol.
En additionnant ces valeurs, la masse molaire de LiAlH4 est d’environ 37,95 g/mol.
Hydrure de lithium et d’aluminium (LiAlH4) Point d’ébullition
Le tétrahydridoaluminate de lithium (LiAlH4) n’a pas de point d’ébullition distinct car il se décompose avant d’atteindre le point d’ébullition de l’un de ses composants individuels. Lors du chauffage, LiAlH4 subit une réaction de décomposition, libérant de l’hydrogène gazeux.
Hydrure de lithium et d’aluminium (LiAlH4) Point de fusion
Le tétrahydridoaluminate de lithium (LiAlH4) a un point de fusion relativement bas. Il fond à environ 150-160°C (302-320°F). À cette température, le solide LiAlH4 se transforme en état liquide, lui permettant de participer à des réactions chimiques.
Hydrure de lithium et d’aluminium (LiAlH4) Densité g/mL
La densité du tétrahydridoaluminate de lithium (LiAlH4) est d’environ 0,917 g/mL. Cette valeur de densité indique la masse de LiAlH4 présente dans un volume spécifique, avec l’unité de grammes par millilitre.
Hydrure de lithium et d’aluminium (LiAlH4) Poids moléculaire
Le poids moléculaire du tétrahydridoaluminate de lithium (LiAlH4) est calculé en additionnant les poids atomiques de tous ses éléments constitutifs. Le poids moléculaire de LiAlH4 est d’environ 37,95 g/mol.
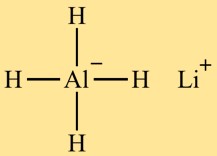
Structure de l’hydrure de lithium et d’aluminium (LiAlH4)
Le tétrahydridoaluminate de lithium (LiAlH4) a une structure tétraédrique. L’atome d’aluminium est au centre, entouré de quatre atomes d’hydrogène. L’atome de lithium est également connecté à l’atome d’aluminium, complétant ainsi la structure.
Solubilité de l’hydrure de lithium et d’aluminium (LiAlH4)
Le tétrahydridoaluminate de lithium (LiAlH4) est insoluble dans la plupart des solvants organiques tels que les éthers et les hydrocarbures. Cependant, il est très réactif avec l’eau, subissant une vigoureuse réaction exothermique et produisant de l’hydrogène gazeux. Par conséquent, LiAlH4 est généralement manipulé et stocké dans des conditions anhydres pour éviter toute réaction indésirable avec l’humidité.
| Apparence | poudre blanche |
| Gravité spécifique | 0,917 g/mL |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 37,95 g/mole |
| Densité | 0,917 g/mL |
| Point de fusion | 150-160°C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit vigoureusement avec l’eau |
| Solubilité | Insoluble dans les solvants organiques tels que les éthers et les hydrocarbures |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Hydrure de lithium et d’aluminium (LiAlH4) Sécurité et dangers
Le tétrahydridoaluminate de lithium (LiAlH4) présente des risques importants pour la sécurité et doit être manipulé avec une extrême prudence. C’est un composé hautement réactif qui réagit violemment avec l’eau, libérant de l’hydrogène gazeux inflammable. LiAlH4 est pyrophorique, ce qui signifie qu’il peut s’enflammer spontanément dans l’air. Il doit être conservé à l’abri de l’humidité et conservé dans des récipients hermétiquement fermés. Le contact direct avec LiAlH4 peut provoquer de graves brûlures et irritations de la peau, des yeux et du système respiratoire. L’inhalation de ses poussières ou de ses fumées peut entraîner une détresse respiratoire. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lorsque vous travaillez avec LiAlH4, et il ne doit être manipulé que dans des zones bien ventilées avec des mesures de sécurité appropriées en place.
| Symboles de danger | F, C |
| Description de la sécurité | Hautement inflammable. Réagit violemment avec l’eau. Manipulez avec une extrême prudence. |
| Numéros d’identification de l’ONU | ONU 1410 |
| Code SH | 2850.00.00 |
| Classe de danger | 4.3 |
| Groupe d’emballage | je |
| Toxicité | Très toxique, peut provoquer de graves brûlures et une détresse respiratoire. |
Remarque : Les symboles de danger utilisés sont « F » pour inflammable et « C » pour corrosif. La description de sécurité met en évidence la réactivité avec l’eau et souligne la nécessité d’une extrême prudence. Les identifiants ONU et le code HS sont des codes d’identification spécifiques utilisés à des fins de transport et de commerce. La classe de danger indique la classification de la substance en fonction de ses caractéristiques. Le groupe d’emballage représente le niveau de danger pendant le transport. Le tétrahydridoaluminate de lithium (LiAlH4) est hautement toxique et peut provoquer de graves brûlures et une détresse respiratoire par contact ou par inhalation.
Méthodes de synthèse de l’hydrure de lithium et d’aluminium (LiAlH4)
Différentes méthodes permettent la synthèse du tétrahydridoaluminate de Lithium (LiAlH4).
Une méthode courante de synthèse du tétrahydridoaluminate de lithium (LiAlH4) consiste à chauffer AlCl3 et à le combiner avec de l’hydrure de lithium (LiH) dans un solvant comme l’éther diéthylique . La réaction se déroule en présence de chaleur, entraînant la formation de LiAlH4.
Une autre méthode consiste à mélanger du métal d’aluminium en poudre avec de l’hydrure de lithium, puis à chauffer le mélange. La réaction se produit conduisant à la formation de LiAlH4.
Pour synthétiser LiAlH4 en utilisant une approche différente, combinez le deutéride de lithium et d’aluminium (LiAlD4) avec LiH dans un solvant tel que le tétrahydrofurane (THF) . Chauffer le mélange, provoquant une réaction entre LiAlD4 et l’hydrure de lithium, entraînant la formation de LiAlH4.
Il convient de noter que ces méthodes de synthèse nécessitent une manipulation prudente en raison de la réactivité des composés impliqués. Des précautions telles que travailler dans des conditions inertes, utiliser un équipement de sécurité approprié et mener les réactions dans des zones bien ventilées sont essentielles pour garantir une synthèse sûre et réussie.
Utilisations de l’hydrure de lithium et d’aluminium (LiAlH4)
Le tétrahydridoaluminate de lithium (LiAlH4) trouve plusieurs applications en chimie organique en raison de ses puissantes propriétés réductrices. Voici quelques utilisations courantes :
- Réduction des composés carbonylés : LiAlH4 convertit considérablement divers composés carbonylés, tels que les aldéhydes, les cétones, les esters et les acides carboxyliques, en leurs alcools correspondants. Cette réaction de réduction est cruciale dans la synthèse de produits pharmaceutiques, de produits chimiques fins et d’intermédiaires organiques.
- Réduction des composés nitro : LiAlH4 peut réduire les composés nitro en amines primaires. Cette transformation est précieuse dans la synthèse d’un large éventail de composés organiques, notamment des produits pharmaceutiques, des colorants et des produits agrochimiques.
- Désoxygénation : LiAlH4 peut éliminer sélectivement les atomes d’oxygène de divers groupes fonctionnels, tels que les alcools, les acides et les oximes. Ce processus de désoxygénation est utile dans la préparation de composés sensibles à l’oxygène ou lorsque la fonctionnalité oxygène doit être éliminée.
- Réactions de polymérisation : LiAlH4 agit comme agent réducteur dans certaines réactions de polymérisation, facilitant la formation de polymères. Les chercheurs utilisent LiAlH4 dans la production de matériaux haute performance, notamment des polymères conducteurs et des plastiques spéciaux.
- Applications synthétiques : LiAlH4 est utilisé dans la synthèse de divers composés organiques, notamment les hydrazines, les phosphines et les composés organométalliques. Ces composés sont essentiels dans la recherche pharmaceutique, la catalyse et la science des matériaux.
- Agent réducteur de laboratoire : LiAlH4 sert d’agent réducteur polyvalent en laboratoire. Il permet aux chimistes de réduire sélectivement des groupes fonctionnels spécifiques, permettant ainsi la synthèse de molécules complexes avec une grande précision.
Dans l’ensemble, le tétrahydridoaluminate de lithium (LiAlH4) joue un rôle crucial dans la synthèse organique, fournissant aux chimistes un outil puissant pour diverses réactions de réduction et permettant la préparation d’une large gamme de composés précieux.
Des questions:
Q : L’hydrure de lithium et d’aluminium réduit-il les doubles liaisons ?
R : Oui, le tétrahydridoaluminate de lithium peut réduire les doubles liaisons et les convertir en liaisons simples.
Q : Quel gaz l’hydrure de lithium et d’aluminium libère-t-il lorsqu’il réagit avec un solvant protique ?
R : Lorsque le tétrahydridoaluminate de lithium réagit avec un solvant protique, il libère de l’hydrogène gazeux.
Q : Où puis-je acheter de l’hydrure de lithium et d’aluminium ?
R : Le tétrahydridoaluminate de lithium peut être acheté auprès de fournisseurs de produits chimiques ou de fournisseurs spécialisés d’équipement de laboratoire.
Q : L’hydrure de lithium et d’aluminium est-il une base ?
R : Non, le tétrahydridoaluminate de lithium n’est pas considéré comme une base mais comme un puissant agent réducteur.
Q : Que réduit LiAlH4 ?
R : Le tétrahydridoaluminate de lithium peut réduire divers groupes fonctionnels, notamment les composés carbonylés, les groupes nitro et les alcools.
Q : L’hydrure de lithium et d’aluminium est-il un nucléophile ?
R : Oui, le tétrahydridoaluminate de lithium agit comme un nucléophile dans de nombreuses réactions organiques en raison de la présence de l’ion hydrure.
Q : L’hydrure de lithium et d’aluminium réduit-il les alcools ?
R : Oui, le tétrahydridoaluminate de lithium peut réduire les alcools pour produire des alcools primaires ou secondaires.
Q : L’hydrure de lithium et d’aluminium réduit-il les alcènes ?
R : Non, le tétrahydridoaluminate de lithium ne réagit généralement pas avec les alcènes.
Q : Avec lequel des solvants ci-dessous l’hydrure de lithium et d’aluminium ne réagira-t-il pas ?
R : Le tétrahydridoaluminate de lithium ne réagit généralement pas avec les solvants non polaires tels que l’hexane ou l’éther diéthylique.
Q : L’hydrure de lithium et d’aluminium affecte-t-il les alcools ?
R : Oui, le tétrahydridoaluminate de lithium peut réduire les alcools, mais il doit être utilisé avec prudence car il peut être très réactif et potentiellement dangereux.
