L’hydrure de lithium est un composé composé de lithium et d’hydrogène. Il est hautement réactif et largement utilisé dans diverses applications, notamment le stockage d’énergie et les réactions nucléaires.
| Nom UICPA | Hydrure de lithium |
| Formule moléculaire | LiH |
| Numero CAS | 7580-67-8 |
| Synonymes | Monohydrure de lithium, lithane, hydrure de lithium, hydrure de lithium |
| InChI | InChI=1S/Li.H |
Propriétés de l’hydrure de lithium
Formule d’hydrure de lithium
La formule du monohydrure de lithium est LiH. Il est constitué d’un atome de lithium lié à un atome d’hydrogène. Cette formule simple et concise représente la composition élémentaire du monohydrure de lithium.
Hydrure De Lithium Masse molaire
La masse molaire du monohydrure de lithium est calculée en additionnant les masses atomiques du lithium (Li) et de l’hydrogène (H). C’est environ 7,95 grammes par mole (g/mol). La masse molaire est essentielle pour divers calculs en chimie, tels que la détermination de la quantité de substance dans un échantillon donné.
Point d’ébullition de l’hydrure de lithium
Le monohydrure de lithium a un point d’ébullition élevé d’environ 1 350 degrés Celsius (2 462 degrés Fahrenheit). Cela indique qu’il faut une quantité importante d’énergie pour convertir le composé solide à l’état gazeux.
Point de fusion de l’hydrure de lithium
Le point de fusion du monohydrure de lithium est assez élevé, à environ 688 degrés Celsius (1 270 degrés Fahrenheit). Cette température représente le point auquel le composé solide se transforme en état liquide lors du chauffage.
Densité de l’hydrure de lithium g/mL
La densité du monohydrure de lithium est d’environ 0,82 gramme par millilitre (g/mL). Cette valeur indique que le monohydrure de lithium est un composé relativement dense, ce qui signifie qu’il a une masse par unité de volume importante.
Poids moléculaire de l’hydrure de lithium
Le poids moléculaire du monohydrure de lithium est déterminé en additionnant les poids atomiques du lithium et de l’hydrogène. C’est environ 7,95 grammes par mole (g/mol). Le poids moléculaire est crucial dans divers calculs chimiques, notamment pour déterminer la stœchiométrie des réactions.
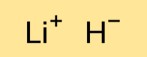
Structure d’hydrure de lithium
Le monohydrure de lithium a une structure cristalline dans laquelle les cations lithium (Li+) et les anions hydrure (H-) sont disposés dans un réseau tridimensionnel. Les atomes de lithium et d’hydrogène sont maintenus ensemble par de fortes liaisons ioniques.
Solubilité de l’hydrure de lithium
Le monohydrure de lithium est peu soluble dans l’eau. Il réagit avec l’eau pour former de l’hydroxyde de lithium (LiOH) et de l’hydrogène gazeux (H2). Cette solubilité limitée est due à la nature hautement ionique du monohydrure de lithium, ce qui le rend moins susceptible de se dissoudre dans des solvants polaires comme l’eau.
| Apparence | Solide blanc |
| Gravité spécifique | 0,82 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 7,95 g/mole |
| Densité | 0,82 g/ml |
| Point de fusion | 688 °C (1 270 °F) |
| Point d’ébullition | 1 350 °C (2 462 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit avec l’eau pour former de l’hydroxyde de lithium (LiOH) et de l’hydrogène gazeux (H2). |
| Solubilité | Peu soluble |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers liés à l’hydrure de lithium
Le monohydrure de lithium présente plusieurs risques pour la sécurité. Il réagit violemment avec l’eau, libérant de l’hydrogène gazeux inflammable et produisant de l’hydroxyde de lithium corrosif. Le contact avec l’humidité ou l’air peut provoquer la formation d’hydrogène gazeux hautement inflammable. Il doit être manipulé avec une extrême prudence pour éviter une inflammation accidentelle ou une explosion. Le composé est également très réactif avec les acides, libérant de l’hydrogène gazeux toxique. Le monohydrure de lithium peut provoquer une grave irritation de la peau et des yeux, et l’inhalation de ses poussières ou de ses fumées peut entraîner une détresse respiratoire. Un équipement de protection approprié, tel que des gants et des lunettes, doit être porté lorsque vous travaillez avec du monohydrure de lithium et doit être stocké dans un endroit sec et bien ventilé.
| Symboles de danger | Inflammable, Corrosif |
| Description de la sécurité | Très réactif et inflammable. Manipulez avec une extrême prudence. Évitez tout contact avec l’eau, l’air et les acides. |
| Numéros d’identification de l’ONU | ONU 1414 |
| Code SH | 2850.00.10 |
| Classe de danger | 4.3 (Dangereux lorsqu’il est mouillé) |
| Groupe d’emballage | Je (Grand danger) |
| Toxicité | Toxique par ingestion ou inhalation. Peut provoquer une grave irritation de la peau et des yeux. |
Méthodes de synthèse de l’hydrure de lithium
Diverses méthodes permettent de synthétiser le monohydrure de lithium.
Une méthode courante implique la combinaison directe du lithium métallique avec de l’hydrogène gazeux. La réaction a lieu à des températures élevées, généralement supérieures à 600 degrés Celsius (1 112 degrés Fahrenheit), dans un environnement contrôlé. Le lithium métallique réagit avec l’hydrogène gazeux pour former du monohydrure de lithium.
Une autre méthode est la réduction de l’amidure de lithium (LiNH2) avec du lithium métallique. Cette réaction se produit à des températures plus basses, autour de 350 à 400 degrés Celsius (662 à 752 degrés Fahrenheit). La réaction de l’amidure de lithium avec le lithium métallique produit du monohydrure de lithium.
La synthèse du monohydrure de lithium peut également se produire en combinant le borohydrure de lithium (LiBH4) avec le monohydrure de lithium lui-même. La réaction a lieu à des températures élevées, généralement autour de 400 degrés Celsius (752 degrés Fahrenheit). Cette méthode permet la formation de monohydrure de lithium à partir de borohydrure de lithium facilement disponible.
De plus, l’hydrure de lithium et d’aluminium (LiAlH4) sert de matière première pour la synthèse du monohydrure de lithium. Dans des conditions contrôlées, l’hydrure de lithium et d’aluminium réagit avec le lithium métallique, entraînant la formation de monohydrure de lithium.
Il convient de noter que ces méthodes nécessitent une manipulation soigneuse et un contrôle strict des conditions de réaction en raison de la nature hautement réactive du monohydrure de lithium. Des précautions de sécurité, telles que travailler dans une atmosphère inerte et utiliser un équipement de protection approprié, doivent être suivies pendant le processus de synthèse.
Utilisations de l’hydrure de lithium
Le monohydrure de lithium trouve diverses applications en raison de ses propriétés et de sa réactivité uniques. Voici quelques-unes de ses utilisations :
- Le monohydrure de lithium permet le développement de systèmes avancés de stockage d’hydrogène, facilitant des solutions de stockage d’énergie efficaces et compactes.
- Dans les réactions nucléaires, il agit comme une source de neutrons et trouve des applications dans les installations de recherche et les centrales nucléaires.
- La synthèse organique utilise le monohydrure de lithium comme agent réducteur puissant pour réduire divers groupes fonctionnels.
- Il génère de l’hydrogène gazeux par sa réaction avec l’eau ou des acides, ce qui le rend précieux pour la production d’hydrogène sur site.
- Lorsqu’il est combiné avec d’autres propulseurs, le monohydrure de lithium contribue à la production d’énergie et à la poussée des moteurs de fusée.
- Le monohydrure de lithium joue un rôle dans la production de deutérium gazeux, qui trouve des applications dans la production d’énergie nucléaire et la recherche scientifique.
- Les procédés hydrométallurgiques utilisent le monohydrure de lithium pour produire divers métaux comme le titane et le zirconium.
- Il sert de précurseur ou de réactif dans la synthèse chimique, contribuant à la formation de composés organiques et inorganiques.
- Certaines formulations pyrotechniques utilisent du monohydrure de lithium pour générer une chaleur et des gaz intenses lors de la réaction.
- Les réactions d’hydrogénation utilisent le monohydrure de lithium pour ajouter de l’hydrogène aux composés insaturés, formant ainsi des composés saturés.
Ces diverses applications mettent en évidence la polyvalence et l’importance du monohydrure de lithium dans de multiples industries et efforts scientifiques.
Des questions:
Q : Quelle est la formule de l’hydrure formé par le lithium ?
R : La formule du monohydrure formé par le lithium est LiH.
Q : L’hydrure de lithium réduit-il les doubles liaisons ?
R : Oui, le monohydrure de lithium peut réduire les doubles liaisons dans les composés organiques.
Q : Que réduit l’hydrure de lithium ?
R : Le LiH est un puissant agent réducteur couramment utilisé pour réduire divers groupes fonctionnels en synthèse organique.
Q : L’hydrure de lithium est-il ionique ou covalent ?
R : Le monohydrure de lithium est un composé ionique composé de cations Li+ et d’anions H-.
Q : Quelle est la différence entre les batteries lithium-ion et les batteries nickel-hydrure métallique ?
R : Les batteries Li-ion offrent une densité énergétique plus élevée, une durée de vie plus longue et un poids plus léger que les batteries nickel-hydrure métallique.
Q : Quel est le mécanisme de l’hydrure de lithium ?
R : Le mécanisme du monohydrure de lithium varie en fonction de sa réaction et de son application spécifiques. Il peut agir comme agent réducteur ou réagir avec l’eau, les acides ou d’autres composés.
Q : L’hydrure de lithium est-il un nucléophile ?
R : Oui, le monohydrure de lithium peut agir comme nucléophile dans certaines réactions chimiques.
Q : Quels objets utilisent l’hydrure de lithium pour créer ?
R : Le monohydrure de lithium est principalement utilisé dans des applications industrielles, telles que les systèmes de stockage d’énergie, les réactions nucléaires, la production d’hydrogène et la synthèse chimique.
Q : L’hydrure de lithium réduit-il les alcools ?
R : Le monohydrure de lithium peut réduire les alcools en alcanes ou aldéhydes correspondants en fonction des conditions de réaction et d’autres facteurs.
