Le dichromate de potassium est un composé chimique orange vif utilisé dans diverses applications. C’est un agent oxydant puissant et peut être toxique s’il est ingéré ou inhalé.
| Nom UICPA | Dichromate de potassium |
| Formule moléculaire | K2Cr2O7 |
| Numero CAS | 7778-50-9 |
| Synonymes | Bichromate de potassium, Chromate de potassium (VI), Bichromate de potasse |
| InChI | InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;;;/h;;2*;7*1- |
Propriétés du bichromate de potassium
Formule de dichromate de potassium
La formule du bichromate de potassium est K2Cr2O7. Il se compose de deux atomes de potassium (K), de deux atomes de chrome (Cr) et de sept atomes d’oxygène (O). Chaque atome de potassium a une charge +1, tandis que chaque atome de chrome a une charge +6. La présence de deux atomes de chrome dans la formule indique la structure dimère du composé.
Dichromate De Potassium Masse molaire
La masse molaire du bichromate de potassium est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le potassium a une masse molaire de 39,10 grammes par mole (g/mol), le chrome a une masse molaire de 52,00 g/mol et l’oxygène a une masse molaire de 16,00 g/mol. La masse molaire du bichromate de potassium est donc de 294,18 g/mol.
Point d’ébullition du dichromate de potassium
Le bichromate de potassium n’a pas de point d’ébullition spécifique, car il se décompose avant d’atteindre un point d’ébullition. Cependant, lorsqu’il est chauffé, il subit une décomposition thermique, libérant des fumées toxiques d’oxyde de chrome et d’oxygène.
Dichromate de potassium Point de fusion
Le point de fusion du bichromate de potassium est d’environ 398 degrés Celsius (°C) ou 748 degrés Fahrenheit (°F). A cette température, les cristaux solides de bichromate de potassium se transforment à l’état liquide.
Densité du dichromate de potassium g/mL
La densité du bichromate de potassium est d’environ 2,68 grammes par millilitre (g/mL). Cela indique qu’un volume donné de bichromate de potassium est relativement plus lourd qu’un volume égal d’eau.
Potassium Dichromate Poids moléculaire
Le poids moléculaire du bichromate de potassium est le même que sa masse molaire, qui est de 294,18 grammes par mole (g/mol). Il représente la masse combinée de tous les atomes présents dans une molécule du composé.
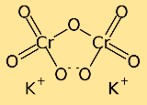
Structure du dichromate de potassium
Le bichromate de potassium a une structure dimère, ce qui signifie qu’il est constitué de deux atomes de chrome liés l’un à l’autre par des atomes d’oxygène. Les atomes de potassium sont également liés aux atomes d’oxygène, créant ainsi un réseau complexe d’atomes dans le composé.
Solubilité du dichromate de potassium
Le bichromate de potassium est très soluble dans l’eau. Il se dissout facilement dans l’eau pour former une solution orange. La solubilité du bichromate de potassium augmente avec la température. Cependant, sa solubilité dans les solvants organiques est limitée.
| Apparence | Cristaux orange vif |
| Gravité spécifique | 2,68 g/ml |
| Couleur | Orange |
| Odeur | Inodore |
| Masse molaire | 294,18 g/mole |
| Densité | 2,68 g/ml |
| Point de fusion | 398 °C (748 °F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, limité dans les solvants organiques |
| La pression de vapeur | Négligeable |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | Acide (environ pH 4) |
Sécurité et dangers du bichromate de potassium
Le bichromate de potassium présente des risques importants pour la sécurité. Il est hautement toxique s’il est ingéré, inhalé ou entre en contact avec la peau. Le composé est un agent oxydant puissant qui peut réagir violemment avec les matériaux combustibles, augmentant ainsi le risque d’incendie. L’exposition au bichromate de potassium peut provoquer de graves irritations cutanées, des brûlures et des réactions allergiques. L’inhalation de ses fumées ou de ses poussières peut entraîner des problèmes respiratoires et des lésions pulmonaires. L’exposition à long terme est associée à des effets néfastes sur la santé, notamment le cancer du poumon induit par les chromates. Il est essentiel de manipuler le bichromate de potassium avec une extrême prudence, en portant un équipement de protection approprié et en assurant une ventilation adéquate afin de minimiser les risques pour la santé et la sécurité.
| Symboles de danger | Corrosif, Danger pour la santé, Toxique aigu |
| Description de la sécurité | – Très toxique – Corrosif – Provoque des brûlures |
| Numéros d’identification de l’ONU | ONU 3086 (classe 6.1) |
| Code SH | 2841.10.10 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | Toxicité orale aiguë : Très toxique<br>Toxicité chronique : Potentiel cancérigène |
Remarque : Les symboles de danger utilisés dans le tableau sont des symboles internationaux communément reconnus. Il est important de se référer aux réglementations spécifiques et aux consignes de sécurité pour obtenir des informations complètes sur la manipulation et le stockage du bichromate de potassium.
Méthodes de synthèse du dichromate de potassium
Plusieurs méthodes permettent de synthétiser le bichromate de potassium. Une méthode couramment utilisée implique la réaction entre le chromate de potassium (K2CrO4) et l’acide chromique (H2CrO4) . La réaction se déroule dans un milieu acide, généralement avec de l’acide sulfurique (H2SO4) comme catalyseur. La réaction peut le résumer.
2K2CrO4 + 2H2CrO4 + 2H2SO4 → K2Cr2O7 + Cr2(SO4)3 + 4H2O
Une autre méthode implique l’oxydation du chromate de potassium à l’aide d’un agent oxydant puissant, tel que l’acide sulfurique concentré (H2SO4) , et d’un agent réducteur, tel que l’éthanol (C2H5OH). La réaction peut le résumer.
2K2CrO4 + H2SO4 + 3C2H5OH → K2Cr2O7 + Cr2(SO4)3 + 7H2O + 3CO2
L’hydroxyde de potassium (KOH) réagit avec le trioxyde de chrome (CrO3) dans un milieu aqueux pour produire du bichromate de potassium. En milieu aqueux, la réaction a lieu. La réaction peut le résumer.
2KOH + CrO3 → K2Cr2O7 + H2O
Ces méthodes de synthèse nécessitent des précautions de sécurité appropriées en raison de la nature toxique et corrosive des réactifs impliqués. Il est important d’effectuer ces réactions dans un endroit bien ventilé, de porter un équipement de protection et de manipuler les produits chimiques avec précaution. De plus, le respect des protocoles appropriés d’élimination des déchets est essentiel pour minimiser l’impact environnemental.
Utilisations du dichromate de potassium
Le bichromate de potassium trouve des applications dans divers domaines en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations courantes :
- Agent oxydant : Les réactions chimiques utilisent largement le bichromate de potassium comme agent oxydant puissant pour oxyder les alcools en aldéhydes ou en cétones.
- Réactif de laboratoire : la chimie analytique utilise le bichromate de potassium comme réactif pour les tests et les expériences, notamment la détermination des composés organiques et la réalisation de réactions redox.
- Industrie du tannage : L’industrie du cuir utilise le bichromate de potassium comme agent de bronzage pour traiter les peaux d’animaux et les transformer en produits en cuir durables.
- Photographie : La photographie en noir et blanc incorpore du bichromate de potassium dans des solutions de développement et l’utilise pour sensibiliser les émulsions afin d’obtenir des effets photographiques spécifiques.
- Préservation du bois : Pour protéger le bois contre la pourriture, les champignons et les attaques d’insectes, l’industrie de la préservation du bois utilise le bichromate de potassium comme agent de préservation du bois hautement toxique.
- Fabrication de pigments : le bichromate de potassium joue un rôle essentiel dans la production de pigments tels que le jaune de chrome et l’orange de chrome, que les industries utilisent dans les peintures, les encres et les colorants.
- Galvanoplastie : les procédés de galvanoplastie utilisent du bichromate de potassium pour fournir un revêtement décoratif et résistant à la corrosion sur les métaux, notamment le zinc, l’aluminium et le laiton.
- Pyrotechnie : Le bichromate de potassium joue un rôle essentiel dans les mélanges pyrotechniques, apportant des couleurs orange vif aux feux d’artifice et aux fusées éclairantes.
- Industrie textile : La teinture et l’impression des textiles incorporent du bichromate de potassium pour obtenir les couleurs souhaitées et améliorer la solidité des couleurs.
- Calibrage de la verrerie de laboratoire : Pour des mesures de volume précises, les solutions de bichromate de potassium servent à calibrer la verrerie de laboratoire.
Ces diverses applications mettent en évidence la polyvalence et l’importance du bichromate de potassium dans diverses industries et efforts scientifiques.
Des questions:
Q : Quelle est la formule correcte pour le bichromate de potassium ?
R : La formule correcte pour le bichromate de potassium est K2Cr2O7.
Q : Qu’est-ce que le dichromate de potassium ?
R : Le bichromate de potassium est un composé chimique de couleur orange vif et est couramment utilisé comme agent oxydant.
Q : Le dichromate de potassium est-il ionique ou covalent ?
R : Le bichromate de potassium est un composé ionique.
Q : Quelle est la quantité minimale d’eau nécessaire pour dissoudre 3 moles de dichromate de potassium ?
R : La quantité minimale d’eau nécessaire pour dissoudre 3 moles de bichromate de potassium est d’environ 564 grammes.
Q : Quelle est la masse molaire du bichromate de potassium ?
R : La masse molaire du bichromate de potassium est de 294,18 grammes par mole (g/mol).
Q : Fiche signalétique de bichromate de potassium ?
R : Les fiches signalétiques (FDS) du bichromate de potassium fournissent des informations détaillées sur ses dangers, sa manipulation, son stockage et ses mesures de premiers secours. Veuillez vous référer à des sources ou des fabricants fiables pour la fiche signalétique spécifique.
Q : Comment le bichromate de potassium est-il préparé à partir du minerai de chromite ?
R : Le bichromate de potassium peut être préparé à partir du minerai de chromite en le grillant avec de l’hydroxyde de potassium ou du carbonate de potassium, puis en isolant le produit.
Q : Combien de grammes de bichromate de potassium ont été ajoutés à la fiole jaugée ?
R : Le nombre exact de grammes de bichromate de potassium ajoutés à la fiole jaugée dépend de la concentration et du volume souhaités de la solution.
Q : Comment feriez-vous la distinction entre le propanal et la propanone en utilisant du bichromate de potassium acidifié ?
R : Le propanal serait oxydé en acide propanoïque par le bichromate de potassium acidifié, tandis que la propanone (acétone) ne présenterait aucune réaction.
Q : Le bichromate de potassium est-il un agent réducteur ?
R : Non, le bichromate de potassium est un agent oxydant.
Q : Comment écrire la formule du dichromate de potassium ?
R : La formule du bichromate de potassium s’écrit K2Cr2O7.
