Le benzoate de sodium est un conservateur alimentaire. Il prolonge la durée de conservation, inhibe la croissance des bactéries et des champignons et est couramment utilisé dans les boissons, les condiments et les aliments transformés.
| Nom UICPA | Benzoate de sodium |
| Formule moléculaire | C7H5O2Na |
| Numero CAS | 532-32-1 |
| Synonymes | Sel de sodium de l’acide benzoïque, Benzoate de soude, Sel de sodium de l’acide benzoïque |
| InChI | InChI=1S/C7H6O2.Na/c8-7(9)6-4-2-1-3-5-6;/h1-5H,(H,8,9);/q;+1/p-1 |
Propriétés du benzoate de sodium
Formule de benzoate de sodium
La formule du sel de sodium de l’acide benzoïque est C7H5O2Na. Il se compose de sept atomes de carbone, cinq atomes d’hydrogène, deux atomes d’oxygène et un atome de sodium. La présence de l’atome de sodium confère au sel de sodium de l’acide benzoïque ses propriétés caractéristiques.
Benzoate De Sodium Masse molaire
La masse molaire du sel de sodium de l’acide benzoïque est calculée en additionnant les masses atomiques de tous ses atomes constitutifs. C’est environ 144,11 grammes par mole. La masse molaire est utile pour déterminer la quantité de sel de sodium de l’acide benzoïque dans un échantillon donné.
Point d’ébullition du benzoate de sodium
Le point d’ébullition du sel de sodium de l’acide benzoïque est une caractéristique importante. À pression atmosphérique standard, son point d’ébullition est d’environ 410 degrés Celsius (770 degrés Fahrenheit). Ce point d’ébullition élevé assure la stabilité et le rend adapté à diverses applications.
Benzoate de sodium Point de fusion
Le sel de sodium de l’acide benzoïque a un point de fusion relativement bas. Il fond généralement à environ 300 degrés Celsius (572 degrés Fahrenheit). Le faible point de fusion permet un traitement et une incorporation faciles dans divers produits.
Densité du benzoate de sodium g/mL
La densité du sel de sodium de l’acide benzoïque est mesurée en grammes par millilitre (g/mL). Il a une densité d’environ 1,44 g/mL. La densité fournit des informations sur la compacité de la substance et est utile pour divers calculs et formulations.
Benzoate De Sodium Poids moléculaire
Le poids moléculaire du sel de sodium de l’acide benzoïque est la somme des poids atomiques de ses atomes constitutifs. Il est calculé à environ 144,11 grammes par mole. Le poids moléculaire est important pour déterminer la stœchiométrie et d’autres propriétés du composé.
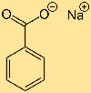
Structure du benzoate de sodium
La structure du sel de sodium de l’acide benzoïque consiste en un cycle benzénique attaché à un groupe carboxyle. L’ion sodium est présent sous forme de cation, contrebalançant la charge négative du groupe carboxylate. Cette structure contribue à sa stabilité et sa solubilité dans divers solvants.
Solubilité du benzoate de sodium
Le sel de sodium de l’acide benzoïque est hautement soluble dans l’eau. Il se dissout facilement pour former une solution claire et incolore. La solubilité dans l’eau permet son utilisation efficace comme conservateur alimentaire et dans diverses formulations à base aqueuse. Il présente également une certaine solubilité dans les solvants organiques comme l’éthanol et le glycérol.
Ces caractéristiques et propriétés du sel de sodium de l’acide benzoïque en font un composé précieux dans diverses industries, notamment l’alimentation et les boissons, les produits pharmaceutiques et les produits de soins personnels.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,44 (à 20°C) |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 144,11 g/mole |
| Densité | 1,44 g/ml |
| Point de fusion | 300°C |
| Point d’ébullition | 410°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau et les solvants tels que l’éthanol, le glycérol |
| Pression de vapeur | Négligeable |
| Densité de vapeur | Pas disponible |
| pKa | 4.19 |
| pH | 8,5-10,5 |
Sécurité et dangers du benzoate de sodium
Le sel de sodium de l’acide benzoïque est considéré comme sans danger pour la consommation et l’utilisation lorsqu’il est utilisé dans les limites approuvées. Cependant, une consommation ou une exposition excessive peut entraîner des risques potentiels pour la santé. Il est essentiel de suivre les directives réglementaires et d’éviter de dépasser les doses recommandées. Dans de rares cas, certaines personnes peuvent présenter des réactions indésirables ou des allergies. En tant que conservateur alimentaire, il est important de maintenir de bonnes conditions de stockage et d’éviter toute contamination. De plus, le sel de sodium de l’acide benzoïque ne doit pas être mélangé à certaines substances comme l’acide citrique ou la vitamine C, car il pourrait former du benzène, un composé potentiellement nocif. Dans l’ensemble, l’utilisation responsable du sel de sodium de l’acide benzoïque et dans les limites réglementées garantit son utilisation sûre et efficace.
| Symboles de danger | Aucun |
| Description de la sécurité | Évitez toute consommation ou exposition excessive. Suivez les directives réglementaires. Stockage et manipulation appropriés requis. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2916.31.00 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Généralement considéré comme sûr lorsqu’il est utilisé dans les limites approuvées. Peut provoquer des réactions indésirables ou des allergies chez certaines personnes. |
Méthodes de synthèse du benzoate de sodium
Diverses méthodes synthétisent le sel de sodium de l’acide benzoïque.
Une méthode couramment utilisée est la réaction entre l’acide benzoïque et l’hydroxyde de sodium . Dans ce processus, l’eau dissout l’acide benzoïque et l’hydroxyde de sodium est la solution ajoutée. Le mélange est chauffé et agité pour faciliter la réaction. Par conséquent, la réaction produit du sel de sodium d’acide benzoïque ainsi que de l’eau comme sous-produit. Ce qui précède peut être reformulé comme suit :
C6H5COOH + NaOH → C6H5COONa + H2O
Une autre méthode implique la réaction entre l’acide benzoïque et le bicarbonate de sodium . Dans cette méthode, vous dissolvez l’acide benzoïque dans un solvant, tel que l’éthanol ou l’eau, et vous ajoutez du bicarbonate de sodium à la solution. Ensuite, vous chauffez et remuez le mélange pour faciliter la réaction. La réaction produit du sel de sodium d’acide benzoïque, ainsi que du dioxyde de carbone et de l’eau comme sous-produits. Ce qui précède peut être représenté comme suit :
C6H5COOH + NaHCO3 → C6H5COONa + CO2 + H2O
Ces méthodes de synthèse offrent des moyens efficaces de produire du sel de sodium d’acide benzoïque à l’échelle industrielle. Cependant, il est important de suivre les mesures de sécurité appropriées et de manipuler les produits chimiques avec prudence pendant le processus de synthèse.
Utilisations du benzoate de sodium
Le sel de sodium de l’acide benzoïque trouve diverses utilisations dans différentes industries en raison de ses propriétés bénéfiques. Voici quelques applications courantes :
- Conservation des aliments : les fabricants d’aliments et de boissons utilisent largement le sel de sodium de l’acide benzoïque comme conservateur pour prolonger la durée de conservation en inhibant la croissance des bactéries, des levures et des moisissures.
- Additif alimentaire : Les fabricants ajoutent de l’acide benzoïque et du sel de sodium à divers produits alimentaires comme les confitures, les boissons gazeuses, les cornichons, les sauces et les vinaigrettes pour améliorer la saveur, la texture et la qualité globale.
- Utilisations médicinales : Les sociétés pharmaceutiques incorporent du sel de sodium d’acide benzoïque dans les médicaments et les formulations pharmaceutiques comme conservateur pour maintenir la stabilité et prévenir la croissance microbienne.
- Produits de soins personnels : les fabricants de produits cosmétiques, de soins de la peau et de soins capillaires utilisent le sel de sodium de l’acide benzoïque comme conservateur pour empêcher la croissance de bactéries, de champignons et d’autres micro-organismes.
- Applications industrielles : les industries telles que les peintures, les colorants et les revêtements incorporent du sel de sodium d’acide benzoïque comme additif pour prévenir la contamination microbienne et améliorer la longévité du produit.
- Alimentation animale : le sel de sodium de l’acide benzoïque est un ajout à l’alimentation animale pour préserver sa qualité et inhiber la croissance de micro-organismes nuisibles.
- Réactif de laboratoire : Les laboratoires chimiques utilisent le sel de sodium de l’acide benzoïque comme réactif dans diverses expériences et réactions.
- Traitement de l’eau : le sel de sodium de l’acide benzoïque sert d’inhibiteur de corrosion et de biocide dans les processus de traitement de l’eau.
- Utilisations agricoles : Le sel de sodium de l’acide benzoïque a une utilisation limitée en agriculture comme fongicide pour protéger les cultures contre les infections fongiques.
- Feux d’artifice : le sel de sodium de l’acide benzoïque trouve un emploi dans la pyrotechnie pour générer des couleurs vibrantes lorsqu’il est combiné avec d’autres composés.
La diversité des applications démontre la polyvalence et l’importance du sel de sodium de l’acide benzoïque dans différents secteurs.
Des questions:
Q : Le benzoate de sodium est-il nocif ?
R : Le sel de sodium de l’acide benzoïque est considéré comme sans danger pour la consommation lorsqu’il est utilisé dans les limites approuvées, mais une consommation ou une exposition excessive doit être évitée.
Q : Quelle quantité de benzoate de sodium utiliser dans la confiture ?
R : Le niveau d’utilisation recommandé de sel de sodium d’acide benzoïque dans la confiture est d’environ 0,1 à 0,2 % en poids.
Q : Quelle quantité de benzoate de sodium utiliser dans le jus ?
R : Le niveau d’utilisation recommandé de sel de sodium d’acide benzoïque dans le jus est généralement de 0,05 à 0,1 % en poids.
Q : Le benzoate de sodium est-il un antioxydant ?
R : Non, le sel de sodium de l’acide benzoïque est principalement utilisé comme agent conservateur et antimicrobien, et non comme antioxydant.
Q : Le benzoate de sodium est-il sans danger ?
R : Lorsqu’il est utilisé dans les limites approuvées, le sel de sodium de l’acide benzoïque est considéré comme sans danger pour la consommation et l’utilisation dans diverses industries.
Q : Qu’est-ce que le benzoate de sodium ?
R : Le sel de sodium de l’acide benzoïque est un sel de sodium de l’acide benzoïque et est couramment utilisé comme conservateur alimentaire.
Q : Où acheter du benzoate de sodium près de chez moi ?
R : Le sel de sodium de l’acide benzoïque peut être acheté auprès de fournisseurs de produits chimiques locaux, de marchés en ligne ou de magasins d’ingrédients alimentaires spécialisés.
Q : Quel est le pH de la solution d’acide benzoïque avant d’ajouter du benzoate de sodium ?
R : Le pH de la solution d’acide benzoïque avant l’ajout du sel de sodium de l’acide benzoïque est généralement acide, autour de 2-3.
Q : Le benzoate de sodium est-il soluble dans l’eau ?
R : Oui, le sel de sodium de l’acide benzoïque est hautement soluble dans l’eau.
Q : La chaleur détruit-elle le benzoate de sodium ?
R : Une chaleur modérée n’affecte pas de manière significative la stabilité du sel de sodium de l’acide benzoïque, ce qui le rend adapté à diverses applications de transformation des aliments et de cuisson.
Q : Le dentifrice Colgate contient-il du benzoate de sodium ?
R : Le sel de sodium de l’acide benzoïque ne se trouve généralement pas dans les formulations de dentifrice Colgate.
Q : Que fait le benzoate de sodium pour la peau ?
R : Le sel de sodium de l’acide benzoïque est utilisé dans les produits de soins de la peau comme conservateur pour empêcher la croissance de micro-organismes et maintenir la qualité du produit.
Q : Le benzoate de sodium est-il sans gluten ?
R : Oui, le sel de sodium de l’acide benzoïque est sans gluten car il n’est pas dérivé de céréales contenant du gluten.
Q : L’oxybenzone est-elle la même chose que le benzoate de sodium ?
R : Non, l’oxybenzone et le sel de sodium de l’acide benzoïque sont des composés chimiques différents avec des propriétés et des utilisations distinctes.
