Le chlorure de fer (III) est un composé formé par la combinaison de fer et de chlore. Il est utilisé comme catalyseur, dans le traitement de l’eau et comme réactif dans les réactions chimiques.
| Nom UICPA | Chlorure de fer(III) |
| Formule moléculaire | FeCl₃ |
| Numero CAS | 7705-08-0 |
| Synonymes | Chlorure ferrique, trichlorure de fer, trichlorofer |
| InChI | InChI=1S/ClH.3Fe/h1H;;;/q;;3*+3/p-3 |
Propriétés du chlorure de fer (III)
Formule de chlorure de fer (III)
La formule du trichlorure de fer est FeCl₃. Il représente la combinaison d’un atome de fer (Fe) et de trois atomes de chlore (Cl). Cette formule indique le rapport stœchiométrique de chaque élément du composé.
Chlorure De Fer(III) Masse molaire
La masse molaire du trichlorure de fer est calculée en additionnant les masses atomiques de tous ses éléments constitutifs. Le fer a une masse atomique de 55,845 g/mol, tandis que le chlore a une masse atomique de 35,453 g/mol. En multipliant la masse atomique du fer par un et la masse atomique du chlore par trois, on obtient une masse molaire de 162,204 g/mol pour le trichlorure de fer.
Point d’ébullition du chlorure de fer (III)
Le trichlorure de fer a un point d’ébullition d’environ 315 °C (599 °F). À cette température, le composé subit une transition de phase d’un liquide à un gaz. Le point d’ébullition est une mesure de la pression de vapeur exercée par la substance lorsque sa température atteint une valeur spécifique.
Point de fusion du chlorure de fer (III)
Le point de fusion du trichlorure de fer est d’environ 306 °C (583 °F). Cette température représente le point auquel le composé solide se transforme en liquide. Le point de fusion est une propriété caractéristique d’une substance et permet de l’identifier.
Densité du chlorure de fer(III) g/mL
La densité du trichlorure de fer est d’environ 2,90 g/mL. La densité est définie comme la masse d’une substance par unité de volume. La densité du trichlorure de fer indique qu’il s’agit d’un composé relativement dense.
Chlorure De Fer(III) Poids moléculaire
Le poids moléculaire du trichlorure de fer est calculé en additionnant les poids atomiques de ses éléments constitutifs. Avec un atome de fer pesant 55,845 g/mol et trois atomes de chlore pesant chacun 35,453 g/mol, le poids moléculaire du trichlorure de fer est de 162,204 g/mol.
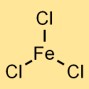
Structure du chlorure de fer (III)
Le trichlorure de fer a une structure de réseau cristallin. Il forme une liaison ionique, l’atome de fer (Fe³⁺) attirant trois ions chlore (Cl⁻). Le composé résultant adopte un arrangement cristallin dans lequel les ions fer chargés positivement sont entourés d’ions chlorure chargés négativement.
Solubilité du chlorure de fer (III)
Le trichlorure de fer est soluble dans l’eau, l’éthanol et d’autres solvants polaires. Lorsqu’il est dissous dans l’eau, il subit une dissociation, formant des cations Fe³⁺ et des anions Cl⁻. La solubilité du trichlorure de fer dans l’eau est influencée par des facteurs tels que la température et la concentration, des températures et des concentrations plus élevées entraînant une solubilité accrue.
| Apparence | Solide jaune-brun |
| Gravité spécifique | 2,90 g/ml |
| Couleur | Jaune marron |
| Odeur | Inodore |
| Masse molaire | 162,204 g/mole |
| Densité | 2,90 g/ml |
| Point de fusion | 306 °C (583 °F) |
| Point d’ébullition | 315 °C (599 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble, influencé par des facteurs tels que la température et la concentration |
| Solubilité | Soluble dans les solvants polaires |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Acide (environ 2) |
Sécurité et dangers du chlorure de fer (III)
Le trichlorure de fer présente certaines considérations et dangers en matière de sécurité. Il est corrosif et peut provoquer de graves irritations de la peau et des yeux. L’inhalation de ses poussières ou de ses fumées peut entraîner une irritation des voies respiratoires. Il est essentiel de manipuler ce composé avec prudence, en portant des équipements de protection appropriés tels que des gants et des lunettes de sécurité. Évitez le contact direct et l’inhalation de la substance. En cas de contact avec la peau ou les yeux, rincer abondamment à l’eau et consulter un médecin si nécessaire. Le trichlorure de fer doit être conservé dans un récipient hermétiquement fermé, à l’écart des substances incompatibles. Suivez les procédures d’élimination appropriées pour éviter la contamination de l’environnement.
| Symboles de danger | Corrosif (C) |
| Description de la sécurité | Provoque de graves brûlures de la peau et des lésions oculaires. |
| Numéros d’identification de l’ONU | UN3264 |
| Code SH | 2827.39.60 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Modérément toxique pour les humains |
Méthodes de synthèse du chlorure de fer (III)
Diverses méthodes permettent de synthétiser le trichlorure de fer.
Une méthode courante implique la réaction entre le fer et le chlore gazeux. Dans un environnement contrôlé, tel qu’un réacteur, la limaille de fer ou la poudre de fer se combinent avec du chlore gazeux à des températures élevées, généralement autour de 300 à 500 °C (572 à 932 °F), initiées par le chauffage du mélange. Le fer réagit avec le chlore , entraînant la formation de trichlorure de fer.
Une autre méthode implique la réaction entre l’oxyde de fer, généralement l’oxyde de fer (III) (Fe₂O₃), et l’acide chlorhydrique (HCl) . Pour favoriser la réaction, l’acide chlorhydrique dissout l’oxyde de fer et le mélange est chauffé. Au fur et à mesure de la réaction, il forme du trichlorure de fer tout en libérant de l’eau.
L’obtention de trichlorure de fer est également possible en faisant réagir directement le fer avec de l’acide chlorhydrique concentré. L’ajout de fer à la solution acide initie la réaction, qui se poursuit avec dégagement d’hydrogène gazeux. Le chauffage du mélange obtenu facilite la conversion du fer en trichlorure de fer.
Il est important de noter que ces méthodes de synthèse doivent être réalisées avec des précautions de sécurité appropriées et dans des zones bien ventilées, car certaines réactions impliquent l’utilisation de substances corrosives et la génération de gaz toxiques.
Utilisations du chlorure de fer (III)
Le trichlorure de fer trouve des applications dans divers domaines en raison de ses propriétés polyvalentes. Voici quelques utilisations courantes :
- Traitement de l’eau : La coagulation dans les processus de traitement de l’eau utilise largement le trichlorure de fer pour éliminer les impuretés et les particules en suspension, rendant l’eau propre à la consommation.
- Agent de gravure : L’industrie électronique utilise le trichlorure de fer comme agent de gravure pour produire des cartes de circuits imprimés, graver sélectivement le cuivre et permettre la création de modèles de circuits.
- Catalyseur : le trichlorure de fer catalyse diverses réactions chimiques, dont la synthèse de composés organiques et la chloration des composés aromatiques.
- Production de pigments : La production de divers pigments, tels que le bleu de fer et les toners utilisés dans les encres d’imprimerie, implique l’utilisation de trichlorure de fer.
- Fabrication de colorants : La synthèse de colorants, en particulier pour colorer les textiles, le cuir et le papier, utilise du trichlorure de fer.
- Traitement de surface des métaux : L’amélioration de la résistance à la corrosion des métaux, tels que l’aluminium et l’acier inoxydable, implique l’utilisation du trichlorure de fer comme agent de traitement de surface.
- Réactif de laboratoire : Le trichlorure de fer est couramment utilisé comme réactif en laboratoire à diverses fins analytiques et synthétiques.
- Applications médicinales : La préparation de certains produits pharmaceutiques, tels que les suppléments de fer et les médicaments utilisés dans le traitement de l’anémie, utilise du trichlorure de fer en médecine.
- Photographie : le trichlorure de fer sert d’agent tonifiant dans les processus photographiques, créant des tons sépia dans la photographie en noir et blanc.
- Industrie textile : Le mordançage et la teinture des tissus dans l’industrie textile utilisent du trichlorure de fer pour améliorer la solidité des couleurs et l’absorption des colorants.
Ces diverses applications mettent en évidence l’importance du trichlorure de fer dans plusieurs industries et domaines scientifiques.
Des questions:
Q : Quelle est la masse molaire du chlorure de fer(III), FeCl₃ ?
R : La masse molaire du trichlorure de fer est de 162,204 g/mol.
Q : Combien d’atomes de fer y a-t-il dans une unité de formule de chlorure de fer (III) ?
R : Il y a un atome de fer dans une unité de formule de trichlorure de fer.
Q : Quelle est la formule du chlorure de fer (III) ?
R : La formule du trichlorure de fer est FeCl₃.
Q : Quelle est la composition en pourcentage en masse du fer dans le chlorure de fer (III) ?
R : La composition en pourcentage en masse de fer dans le trichlorure de fer est d’environ 34,8 %.
Q : Quelle est la formule du chlorure de fer (III) ?
R : La formule du trichlorure de fer est FeCl₃.
Q : Quelle est la masse molaire du chlorure de fer (III) ?
R : La masse molaire du trichlorure de fer est de 162,204 g/mol.
Q : Comment fabriquer du chlorure de fer (III) ?
R : Le trichlorure de fer peut être fabriqué en faisant réagir du fer avec du chlore gazeux ou en dissolvant de l’oxyde de fer dans de l’acide chlorhydrique.
Q : Le chlorure de fer (III) est-il acide ?
R : Oui, le trichlorure de fer est acide et peut abaisser le pH d’une solution.
Q : Quels sont les produits de la réaction entre le zinc métallique et le chlorure de fer (III) ?
R : La réaction entre le zinc métallique et le trichlorure de fer produit du chlorure de zinc et du fer métallique.
Q : Le chlorure de fer (III) est-il toxique ?
R : Le trichlorure de fer est modérément toxique pour les humains et peut provoquer une irritation de la peau et des yeux.
Q : Le chlorure de fer(III) est-il mauvais pour l’environnement ?
R : Le trichlorure de fer peut être nocif pour l’environnement s’il est rejeté en grande quantité, car il peut contaminer les sources d’eau et affecter la vie aquatique.
Q : Comment éliminer le chlorure de fer (III) ?
R : Le trichlorure de fer doit être éliminé correctement conformément aux réglementations locales relatives à l’élimination des déchets dangereux. Contactez les autorités compétentes pour obtenir des conseils.
Q : Quelle est la masse molaire du chlorure de fer (III) ?
R : La masse molaire du trichlorure de fer est de 162,204 g/mol.
