L’acide maléique est un composé organique de formule C4H4O4. C’est un solide cristallin blanc utilisé dans la production de polymères, d’adhésifs et d’additifs alimentaires.
| Nom UICPA | Acide 2,3-dihydroxybutanedioïque |
| Formule moléculaire | C₄H₄O₄ |
| Numero CAS | 110-16-7 |
| Synonymes | Acide cis-butènedioïque, acide cis-1,2-éthylènedicarboxylique, acide toxilique |
| InChI | InChI=1S/C4H4O4/c5-3(6)1-2-4(7)8/h1-2H,(H,5,6)(H,7,8) |
Propriétés de l’acide maléique
Formule d’acide maléique
La formule de l’acide butènedioïque est C4H4O4. Il se compose de quatre atomes de carbone, quatre atomes d’hydrogène et quatre atomes d’oxygène. La formule représente le nombre exact et les types d’atomes présents dans une molécule d’acide butènedioïque.
Acide Maléique Masse molaire
La masse molaire de l’acide butènedioïque est calculée en additionnant les masses atomiques de tous les atomes de sa formule. L’acide butènedioïque a une masse molaire d’environ 116,07 grammes par mole. Cette valeur permet de déterminer la quantité d’acide butènedioïque dans une quantité donnée, en utilisant le concept de taupes.
Point d’ébullition de l’acide maléique
L’acide butènedioïque a un point d’ébullition d’environ 160 à 162 degrés Celsius. Cette température indique le point auquel l’acide butènedioïque passe d’un état liquide à un état gazeux sous pression atmosphérique standard.
Acide maléique Point de fusion
Le point de fusion de l’acide butènedioïque est d’environ 139 à 140 degrés Celsius. Cela signifie la température à laquelle l’acide butènedioïque passe d’une forme solide à une forme liquide. Cette caractéristique peut être utile dans diverses applications et procédés impliquant l’acide butènedioïque.
Densité d’acide maléique g/mL
L’acide butènedioïque a une densité d’environ 1,59 grammes par millilitre. La densité mesure la masse d’une substance par unité de volume. La densité de l’acide butènedioïque détermine son comportement dans différents processus physiques et chimiques, tels que le mélange avec d’autres substances ou la séparation d’elles.
Acide Maléique Poids moléculaire
Le poids moléculaire de l’acide butènedioïque est de 116,07 grammes par mole. C’est la somme des poids atomiques de tous les atomes d’une molécule d’acide butènedioïque. Le poids moléculaire est essentiel dans divers calculs, tels que la détermination de la concentration ou de la quantité d’acide butènedioïque dans une solution.
Structure de l’acide maléique
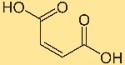
L’acide butènedioïque a une structure constituée de deux groupes carboxyle (COOH) attachés à une structure carbone-carbone (C=C) à double liaison. Cette disposition confère à l’acide butènedioïque ses propriétés et sa réactivité caractéristiques. La structure joue un rôle crucial dans la compréhension de son comportement dans les réactions chimiques et les interactions avec d’autres composés.
Solubilité de l’acide maléique
L’acide butènedioïque est très soluble dans l’eau, avec une solubilité d’environ 633 grammes par litre à 20 degrés Celsius. Cette haute solubilité rend l’acide butènedioïque facilement soluble dans les solutions aqueuses et permet son utilisation dans diverses applications, telles que dans la production de polymères et de produits pharmaceutiques.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,59 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 116,07 g/mole |
| Densité | 1,59 g/ml |
| Point de fusion | 139-140 °C |
| Point d’ébullition | 160-162 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Il est hautement soluble dans les solvants polaires tels que l’eau et l’alcool. |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | 1,92 |
| pH | ~1-2 |
Sécurité et dangers de l’acide maléique
L’acide butènedioïque présente certaines considérations et dangers en matière de sécurité. Il peut provoquer une irritation de la peau, des yeux et du système respiratoire par contact ou par inhalation. Il est conseillé de porter des équipements de protection, tels que des gants et des lunettes, lors de la manipulation de l’acide butènedioïque. En cas d’ingestion accidentelle, des soins médicaux immédiats doivent être recherchés. L’acide butènedioïque est également combustible et des précautions doivent être prises pour éviter toute exposition à des flammes nues ou à des températures élevées. Une bonne ventilation est cruciale pour éviter l’accumulation de vapeurs. Il est important de stocker l’acide butènedioïque dans un endroit sécurisé et bien ventilé, à l’écart des substances incompatibles. Le respect de pratiques de sécurité appropriées est essentiel lorsque vous travaillez avec de l’acide butènedioïque.
| Symboles de danger | Corrosif (C) |
| Description de la sécurité | – Eviter tout contact avec la peau et les yeux, – Utiliser dans un endroit bien aéré, – Porter des gants et des lunettes de protection, – Conserver dans un endroit sécurisé et bien aéré |
| Identifiants des Nations Unies | UN3265 |
| Code SH | 2917.11.00 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | III |
| Toxicité | Peut provoquer une irritation de la peau, des yeux et du système respiratoire. Nocif en cas d’ingestion. |
Méthodes de synthèse d’acide
Diverses méthodes permettent la synthèse de l’acide butènedioïque. Une approche répandue consiste à oxyder l’anhydride maléique avec un agent oxydant, tel que le permanganate de potassium ou le peroxyde d’hydrogène, en présence d’un catalyseur. La réaction donne de l’acide butènedioïque comme produit.
Une autre méthode consiste à hydrolyser l’anhydride maléique en le faisant réagir avec de l’eau, entraînant la formation d’acide butènedioïque. Selon les conditions souhaitées et la vitesse de réaction, cette réaction peut se produire dans des conditions acides ou alcalines.
L’oxydation catalytique du butane ou du benzène produit de l’acide butènedioïque en les oxydant avec de l’air ou de l’oxygène à l’aide d’un catalyseur tel que le pentoxyde de vanadium. Le mélange réactionnel résultant subit d’autres étapes de purification pour isoler l’acide butènedioïque.
De plus, les micro-organismes peuvent fermenter des glucides spécifiques pour synthétiser l’acide butènedioïque. Cette méthode biologique implique l’utilisation de bactéries ou de champignons spécifiques qui produisent de l’acide butènedioïque comme sous-produit métabolique.
Chacune de ces méthodes de synthèse présente des avantages et des considérations concernant les conditions de réaction, l’évolutivité et l’impact environnemental. Le choix de la méthode dépend de facteurs tels que le rendement souhaité, les exigences de pureté et la faisabilité globale du procédé.
Utilisations de l’acide maléique
L’acide butènedioïque trouve diverses applications en raison de ses propriétés polyvalentes. Voici quelques-unes de ses utilisations :
- Production de polymères : la production de polymères, tels que les polyesters et les résines alkydes, utilise l’acide butènedioïque comme précurseur, conférant à ces matériaux des propriétés souhaitables telles que la durabilité et la flexibilité.
- Formulation adhésive : les formulations adhésives contiennent de l’acide butènedioïque pour améliorer leurs capacités de liaison, favorisant ainsi l’adhésion entre différents substrats. Cela le rend utile dans des secteurs tels que la construction et l’automobile.
- Industrie alimentaire et des boissons : dans l’industrie alimentaire et des boissons, l’acide butènedioïque sert d’acidulant et d’exhausteur de goût, ajoutant un goût aigre à divers produits comme les bonbons, les boissons gazeuses et les jus de fruits.
- Industrie textile : L’industrie textile utilise l’acide butènedioïque dans les processus de teinture et de finition, où il agit comme un agent d’égalisation de la teinture, assurant une répartition uniforme de la couleur sur les tissus.
- Applications pharmaceutiques : L’acide butènedioïque trouve des applications dans l’industrie pharmaceutique pour la synthèse d’ingrédients pharmaceutiques actifs (API) et comme ajusteur de pH dans les formulations de médicaments.
- Traitement de l’eau : L’acide butènedioïque contrôle le tartre et la corrosion dans les processus de traitement de l’eau, empêchant ainsi la formation de dépôts minéraux dans les tuyaux et les équipements.
- Cosmétiques et produits de soins personnels : L’acide butènedioïque régule le pH et agit comme agent chélateur dans les cosmétiques et produits de soins personnels, stabilisant les formulations et améliorant leur efficacité.
- Applications agricoles : les dérivés de l’acide butènedioïque fonctionnent comme des régulateurs de croissance des plantes et des herbicides en agriculture, aidant au contrôle de la croissance des mauvaises herbes et à l’amélioration du rendement des cultures.
La gamme diversifiée d’applications de l’acide butènedioïque souligne son importance dans diverses industries, contribuant au développement de nombreux produits et procédés.
Des questions:
Q : Combien d’atomes H ionisables y a-t-il dans chaque molécule d’acide maléique, C4H4O4 ?
R : Il y a deux atomes H ionisables dans chaque molécule d’acide butènedioïque.
Q : L’acide maléique a-t-il un moment dipolaire ?
R : Oui, l’acide butènedioïque a un moment dipolaire en raison de la présence de liaisons polaires au sein de sa structure.
Q : Quelles sont les formules moléculaires du glyoxyle, de l’acide maléique et de l’acide acontique ?
R : Les formules moléculaires sont les suivantes : glyoxyle (C2H2O2), acide butènedioïque (C4H4O4), acide acontique (C6H6O6).
Q : L’acide maléique ou l’acide fumarique sont-ils plus réactifs avec le brome ?
R : L’acide butènedioïque est plus réactif avec le brome que l’acide fumarique.
Q : L’isomérisation de l’acide maléique se produirait-elle si la réaction était effectuée dans de l’eau neutre ?
R : Non, l’isomérisation de l’acide butènedioïque ne se produirait pas dans l’eau neutre.
Q : Dans quelle mesure vos valeurs de pKa1 et de pKa2 pour l’acide maléique étaient-elles proches ?
R : La valeur pKa1 de l’acide butènedioïque est d’environ 1,92, tandis que la valeur pKa2 est d’environ 6,07.
Q : Comment dissoudre l’acide maléique ?
R : L’acide butènedioïque peut être dissous dans l’eau en l’agitant à température ambiante jusqu’à ce qu’il se dissolve complètement.
Q : Quand a-t-on trouvé de l’acide maléique ?
R : L’acide butènedioïque a été découvert en 1834 par le chimiste allemand August Wilhelm von Hofmann.
Q : Comment l’éthanol réagit-il avec l’acide malique pour former de l’acide maléique ?
R : L’éthanol réagit avec l’acide malique en présence d’un agent déshydratant, tel que l’acide sulfurique, pour former de l’acide butènedioïque.
Q : L’acide maléique, lorsqu’il est mélangé avec du HCl et chauffé, forme-t-il de l’acide fumarique ?
R : Oui, l’acide butènedioïque, lorsqu’il est mélangé avec du HCl et chauffé, subit une réaction d’isomérisation pour former de l’acide fumarique.
