Le chlorure de benzoyle est un composé chimique utilisé dans diverses industries. Il réagit avec d’autres substances pour former des dérivés tels que le peroxyde de benzoyle, un ingrédient courant dans les traitements contre l’acné.
| Nom UICPA | Chlorure de benzoyle |
| Formule moléculaire | C7H5ClO |
| Numero CAS | 98-88-4 |
| Synonymes | Acide benzoïque, chlorure, chlorure de benzènecarbonyle, chlorure de phénylcarbonyle |
| InChI | InChI=1S/C7H5ClO/c8-6-7(9)4-2-1-3-5-7/h1-5H |
Propriétés du chlorure de benzoyle
Formule de chlorure de benzoyle
La formule du chlorure de benzoyle est C7H5ClO. Il représente la disposition des atomes de carbone, d’hydrogène, de chlore et d’oxygène dans le composé. La formule fournit des informations précieuses sur la composition élémentaire et la composition structurelle du chlorure de benzoyle.
Chlorure De Benzoyle Masse molaire
La masse molaire du chlorure de benzoyle est calculée en additionnant les masses atomiques de ses éléments constitutifs. Dans ce cas, le carbone a une masse molaire de 12,01 g/mol, l’hydrogène a une masse molaire de 1,01 g/mol, le chlore a une masse molaire de 35,45 g/mol et l’oxygène a une masse molaire de 16,00 g/mol. En additionnant ces valeurs, la masse molaire du chlorure de benzoyle s’avère être d’environ 140,57 g/mol.
Point d’ébullition du chlorure de benzoyle
Le chlorure de benzoyle a un point d’ébullition d’environ 197-198°C. Il s’agit de la température à laquelle le composé liquide passe à l’état gazeux sous pression atmosphérique standard. Le point d’ébullition donne un aperçu des caractéristiques de volatilité et de vaporisation du chlorure de benzoyle.
Point de fusion du chlorure de benzoyle
Le point de fusion du chlorure de benzoyle est d’environ -1°C. Cela signifie la température à laquelle la forme solide du chlorure de benzoyle se transforme en état liquide. Le point de fusion indique les propriétés physiques du composé et sa capacité à passer d’une phase à l’autre.
Densité du chlorure de benzoyle g/mL
Le chlorure de benzoyle a une densité d’environ 1,21 g/mL. La densité fait référence à la masse d’une substance par unité de volume. Cette propriété renseigne sur la compacité ou la concentration du chlorure de benzoyle dans un volume donné.
Chlorure De Benzoyle Poids moléculaire
Le poids moléculaire du chlorure de benzoyle est calculé en additionnant les poids atomiques de tous les atomes d’une molécule. Dans ce cas, le poids moléculaire du chlorure de benzoyle est d’environ 140,57 g/mol. C’est un paramètre essentiel utilisé dans les calculs stœchiométriques et pour déterminer la quantité de chlorure de benzoyle dans les réactions chimiques.
Structure du chlorure de benzoyle
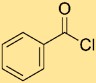
La structure du chlorure de benzoyle est constituée d’un cycle benzène lié à un groupe carbonyle (-C=O) et d’un atome de chlore (-Cl) directement lié à l’atome de carbone du groupe carbonyle. Cet arrangement peut être représenté par PhCOCl, où « Ph » représente le cycle benzénique. La structure met en valeur la connectivité et la liaison des atomes dans le chlorure de benzoyle.
Solubilité du chlorure de benzoyle
Le chlorure de benzoyle est peu soluble dans l’eau. Il présente une solubilité plus élevée dans les solvants organiques tels que l’acétone, l’éther et le benzène. Les caractéristiques de solubilité du chlorure de benzoyle influencent ses applications et ses interactions avec d’autres substances dans divers processus chimiques.
| Apparence | Liquide incolore à jaune pâle |
| Gravité spécifique | 1,21 g/ml |
| Couleur | Incolore à jaune pâle |
| Odeur | Odeur irritante et piquante |
| Masse molaire | 140,57 g/mole |
| Densité | 1,21 g/ml |
| Point de fusion | -1°C |
| Point d’ébullition | 197-198°C |
| Point d’éclair | 77°C |
| Solubilité dans l’eau | Réagit |
| Solubilité | Soluble dans les solvants organiques tels que l’acétone, l’éther et le benzène |
| Pression de vapeur | 4,95 mmHg à 25°C |
| Densité de vapeur | 5.3 |
| pKa | 4.18 |
| pH | Sans objet (acide lorsqu’il est dissous dans l’eau) |
Sécurité et dangers du chlorure de benzoyle
Le chlorure de benzoyle présente certains risques pour la sécurité et doit être manipulé avec prudence. Il est très irritant pour la peau, les yeux et le système respiratoire, provoquant des brûlures et un inconfort sévère au contact. L’inhalation de ses vapeurs peut entraîner une irritation des voies respiratoires et des lésions pulmonaires. Il est essentiel d’utiliser un équipement de protection approprié tel que des gants, des lunettes et un respirateur lorsque vous travaillez avec du chlorure de benzoyle. Le composé est inflammable et peut s’enflammer lors d’une exposition à la chaleur ou aux flammes, libérant des fumées toxiques. De plus, il réagit violemment avec l’eau, les alcools et les bases, provoquant potentiellement des incendies ou des explosions. Des procédures appropriées de stockage, de manipulation et d’élimination doivent être suivies pour minimiser les risques.
| Symboles de danger | Corrosif, Toxique |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Manipuler avec un équipement de protection approprié. |
| Numéros d’identification de l’ONU | ONU 1736 |
| Code SH | 2916.31.00 |
| Classe de danger | 8 (Corrosif), 6.1 (Toxique) |
| Groupe d’emballage | II (Intermédiaire) |
| Toxicité | Très toxique et corrosif. |
Méthodes de synthèse du chlorure de benzoyle
Il existe plusieurs méthodes de synthèse du chlorure de benzoyle. Une approche courante consiste à oxyder le benzaldéhyde à l’aide d’un agent oxydant approprié, tel que le chlore gazeux ou le pentachlorure de phosphore (PCl5). Dans cette méthode, vous mélangez du benzaldéhyde avec l’agent oxydant dans des conditions contrôlées et cela produit du chlorure de benzoyle.
Une autre méthode implique la réaction entre le peroxyde de benzoyle et le chlorure d’hydrogène gazeux. Le peroxyde de benzoyle agit comme un initiateur de radicaux, favorisant la réaction avec le chlorure d’hydrogène pour donner du chlorure de benzoyle.
Pour préparer le chlorure de benzoyle, on peut traiter l’acide benzoïque avec du chlorure de thionyle (SOCl2) ou du trichlorure de phosphore (PCl3) dans des conditions de reflux. La réaction produit un chlorure d’acide comme intermédiaire, qui se transforme ensuite en chlorure de benzoyle.
De plus, la réaction du trichlorure de benzoyle avec le monoxyde de carbone (CO) en présence d’un catalyseur, tel que le cuivre, peut également conduire à la synthèse du chlorure de benzoyle.
Il est important de noter que ces méthodes doivent être effectuées dans un endroit bien ventilé avec des précautions de sécurité appropriées, car le chlorure de benzoyle est un composé dangereux. Une manipulation soigneuse et le respect des protocoles de laboratoire appropriés sont nécessaires pour garantir un processus de synthèse sûr.
Utilisations du chlorure de benzoyle
Le chlorure de benzoyle a diverses utilisations dans différentes industries en raison de ses propriétés chimiques polyvalentes. Voici quelques applications notables :
- Industrie pharmaceutique : L’industrie pharmaceutique utilise le chlorure de benzoyle comme intermédiaire clé pour synthétiser des composés pharmaceutiques, notamment des analgésiques, des antiseptiques et des antihistaminiques.
- Industrie des polymères : Dans l’industrie des polymères, le chlorure de benzoyle agit comme un monomère, contribuant à la stabilité structurelle et à la résistance thermique des polymères tels que les polycarbonates, les polyamides et les polyesters.
- Synthèse organique : Le chlorure de benzoyle sert de réactif dans les réactions d’acylation, facilitant l’introduction du groupe benzoyle dans les molécules organiques.
- Produits agrochimiques : Le chlorure de benzoyle joue un rôle crucial dans la protection des cultures et la lutte antiparasitaire en contribuant à la synthèse d’herbicides et d’insecticides.
- Fabrication de colorants : le chlorure de benzoyle est un précurseur pour la production de divers colorants et pigments, essentiels à la coloration des textiles, des plastiques et des encres d’imprimerie.
- Industrie du parfum et de la parfumerie : L’industrie de la parfumerie et de la parfumerie utilise le chlorure de benzoyle pour synthétiser des parfums et des composés parfumés, améliorant ainsi leurs caractéristiques aromatiques.
- Recherche chimique : les laboratoires de recherche appliquent le chlorure de benzoyle dans la synthèse de nouveaux composés chimiques, contribuant ainsi au développement de matériaux et de produits pharmaceutiques innovants.
- Industrie du caoutchouc : L’industrie du caoutchouc utilise le chlorure de benzoyle comme agent de réticulation pour modifier les propriétés du caoutchouc, améliorant ainsi sa durabilité et sa résistance.
- Fabrication d’adhésifs : les fabricants utilisent du chlorure de benzoyle pour produire des adhésifs et des produits d’étanchéité, améliorant ainsi les propriétés de liaison.
- Industrie textile : Dans l’industrie textile, le chlorure de benzoyle agit comme catalyseur et stabilisant lors de la fabrication de fibres synthétiques telles que le nylon, le polyester et l’élasthanne, garantissant leur qualité et leurs performances.
Ces diverses applications démontrent l’importance du chlorure de benzoyle dans divers secteurs industriels.
Des questions:
Q : Lequel des réactifs suivants convertit le chlorure de benzoyle en phénylpropylcétone ?
R : Le réactif qui convertit le chlorure de benzoyle en phénylpropylcétone est un réactif de Grignard du bromure de phénylmagnésium (PhMgBr), suivi d’une réaction avec l’halogénure de propyle.
Q : Quel produit serait formé par la réaction du chlorure de benzoyle avec le 4-chlorophénol ?
R : Le produit formé à partir de la réaction du chlorure de benzoyle avec le 4-chlorophénol est le 4-chlorobenzoylphénol.
Q : Comment trouver le rendement de l’ammonolyse du chlorure de benzoyle ?
R : Le rendement de l’ammonolyse du chlorure de benzoyle peut être déterminé en divisant la quantité du produit souhaité obtenu par le rendement théorique et en multipliant par 100 pour l’exprimer en pourcentage.
Q : Le chlorure de benzoyle ou le chlorure de benzyle sont-ils plus électrophiles ?
R : Le chlorure de benzoyle est plus électrophile que le chlorure de benzyle en raison de la présence du groupe carbonyle hautement attracteur d’électrons.
Q : Lequel des réactifs suivants est utilisé dans la réaction suivante ? acide benzoïque en chlorure de benzoyle, hydrolyse du chlorure de benzoyle ?
R : Le réactif utilisé dans la conversion de l’acide benzoïque en chlorure de benzoyle est le chlorure de thionyle (SOCl2), et pour l’hydrolyse du chlorure de benzoyle, il s’agit d’eau ou d’une base aqueuse.
Q : Quels sont les produits formés lorsque le chlorure de benzoyle réagit avec le cyclohexanol ?
R : Les produits formés à partir de la réaction du chlorure de benzoyle avec le cyclohexanol sont le benzoate de cyclohexyle et le chlorure d’hydrogène (HCl).
Q : Comment sécher le chlorure de benzoyle ?
R : Le chlorure de benzoyle peut être séché en ajoutant un agent de séchage approprié tel que du chlorure de calcium anhydre ou du sulfate de magnésium anhydre, suivi d’une filtration.
Q : Qu’est-ce qui est le plus électrophile, le chlorure de benzoyle ou le chlorure de benzyle ?
R : Le chlorure de benzoyle est plus électrophile que le chlorure de benzyle en raison de la présence du groupe carbonyle, qui supprime la densité électronique et augmente l’électrophilie.
Q : Le chlorure de benzoyle est-il soluble dans l’eau ?
R : Non, le chlorure de benzoyle n’est pas soluble dans l’eau. Il réagit avec l’eau pour former de l’acide benzoïque et de l’acide chlorhydrique.
