L’hydroxyde de fer (III) est un composé formé par la réaction du fer avec l’eau. Il est couramment utilisé dans les produits pharmaceutiques, dans le traitement de l’eau et comme pigment dans les peintures.
| Nom UICPA | Hydroxyde de fer (III) |
| Formule moléculaire | Fe(OH)₃ |
| Numero CAS | 20344-49-4 |
| Synonymes | Hydroxyde ferrique, trihydroxyde de fer, hydrate ferrique, oxyhydroxyde de fer (III) |
| InChI | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
Propriétés de l’hydroxyde de fer (III)
Formule d’hydroxyde de fer (III)
La formule de l’hydroxyde de fer (III) est Fe(OH)₃. Cela indique que chaque molécule de Fe(OH)₃ est constituée d’un atome de Fe lié à trois ions OH.
Hydroxyde De Fer (III) Masse molaire
La masse molaire de Fe(OH)₃ peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le fer a une masse molaire de 55,845 g/mol et chaque ion hydroxyde (OH) a une masse molaire de 17,007 g/mol. Par conséquent, la masse molaire de Fe(OH)₃ est d’environ 106,867 g/mol.
Point d’ébullition de l’hydroxyde de fer (III)
Fe(OH)₃ n’a pas de point d’ébullition bien défini puisqu’il se décompose avant d’atteindre son point d’ébullition. Au lieu de cela, il subit une décomposition thermique pour former de l’oxyde de fer (III) et de l’eau lorsqu’il est chauffé.
Point de fusion de l’hydroxyde de fer (III)
Fe(OH)₃ se décompose également lors du chauffage et n’a pas de point de fusion distinct. Il se transforme en oxyde de fer (III) et en eau à des températures élevées.
Densité d’hydroxyde de fer (III) g/mL
La densité de Fe(OH)₃ dépend de divers facteurs tels que son état physique (solide ou solution) et sa concentration. La densité d’une forme solide de Fe(OH)₃ est d’environ 3,4 g/mL.
Hydroxyde De Fer(III) Poids moléculaire
Le poids moléculaire de Fe(OH)₃ est calculé en additionnant les poids atomiques de ses atomes constitutifs. Le poids moléculaire de Fe(OH)₃ est d’environ 106,867 g/mol.
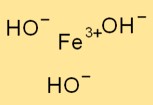
Structure de l’hydroxyde de fer (III)
Fe(OH)₃ adopte une structure trigonale, où un atome de fer est entouré de trois ions hydroxyde. L’atome de fer agit comme l’atome central et les ions hydroxyde y sont liés par des liaisons ioniques.
Solubilité de l’hydroxyde de fer (III)
Fe(OH)₃ a une solubilité limitée dans l’eau. Il forme un précipité lorsqu’il est dissous dans l’eau et sa solubilité dépend de divers facteurs tels que la température, le pH et la présence d’autres ions. La solubilité de Fe(OH)₃ augmente dans des conditions acides.
| Apparence | Solide marron |
| Gravité spécifique | 3.4 |
| Couleur | Brun |
| Odeur | Inodore |
| Masse molaire | 106,867 g/mole |
| Densité | 3,4 g/ml |
| Point de fusion | Se décompose |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Insoluble. Dépend de facteurs tels que la température, le pH et la présence d’autres ions |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Environ 5-7 |
Sécurité et dangers de l’hydroxyde de fer (III)
Fe(OH)₃ pose certaines considérations et dangers en matière de sécurité. Il est généralement considéré comme peu toxique. Cependant, l’ingestion ou l’inhalation de grandes quantités peut provoquer une irritation gastro-intestinale et une gêne respiratoire. Il est important d’éviter tout contact avec les yeux et la peau, car cela pourrait provoquer une irritation. En cas de contact, rincer abondamment à l’eau les zones concernées. Lors de la manipulation de Fe(OH)₃, il est conseillé de porter un équipement de protection approprié, tel que des gants et des lunettes, pour minimiser le risque d’exposition. Une ventilation adéquate doit être assurée pour éviter l’accumulation de poussière. De plus, il est essentiel de suivre les consignes de sécurité et de manipuler Fe(OH)₃ avec prudence afin de minimiser les risques potentiels.
| Symboles de danger | Aucun |
| Description de la sécurité | – Éviter tout contact avec les yeux et la peau <br> – Porter un équipement de protection <br> – Assurer une ventilation adéquate |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2821.10.0000 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’hydroxyde de fer (III)
Il existe différentes méthodes pour synthétiser Fe(OH)₃. Une méthode couramment utilisée implique la réaction de précipitation entre un sel de fer et une base. Par exemple, en ajoutant une solution de chlorure de fer (FeCl₃) à une solution d’ hydroxyde de sodium (NaOH) , Fe(OH)₃ peut être formé. La réaction se produit comme suit :
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
Dans une autre méthode, on peut oxyder l’hydroxyde de fer (II) en Fe (OH)₃ en l’exposant à l’air ou en le traitant avec un agent oxydant. La réaction se produit comme suit :
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
De plus, on peut préparer Fe(OH)₃ en hydrolysant une solution de sel de fer. Ce processus consiste à ajouter de l’eau à la solution de sel de fer, entraînant la formation d’un précipité de Fe(OH)₃. La réaction se produit comme suit :
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Ces méthodes de synthèse offrent des moyens d’obtenir du Fe(OH)₃ pour diverses applications, notamment les produits pharmaceutiques, le traitement de l’eau et comme pigment dans les peintures. Il est important de suivre les précautions de sécurité appropriées et de manipuler les produits chimiques de manière responsable pendant le processus de synthèse.
Utilisations de l’hydroxyde de fer (III)
Fe(OH)₃ a plusieurs applications en raison de ses propriétés uniques. Voici quelques utilisations courantes de Fe(OH)₃ :
- Industrie pharmaceutique : L’industrie pharmaceutique utilise Fe(OH)₃ dans la production de suppléments de fer et de médicaments, tels que ceux utilisés pour traiter l’anémie ferriprive.
- Traitement de l’eau : Les processus de traitement de l’eau utilisent Fe(OH)₃ pour éliminer les contaminants et les impuretés. Fe(OH)₃ agit comme un floculant, contribuant à l’agglomération et à l’élimination des particules en suspension dans l’eau.
- Pigment dans les peintures : Fe(OH)₃, avec sa couleur brune, trouve une application comme pigment dans les peintures, les revêtements et les colorants. Il confère une gamme de tons terreux et est particulièrement utile pour produire des couleurs ocre et terre de Sienne.
- Traitement des eaux usées : les usines de traitement des eaux usées utilisent Fe(OH)₃ pour éliminer les phosphates et les contaminants de métaux lourds des eaux usées industrielles.
- Catalyse : Fe(OH)₃ agit comme un catalyseur dans diverses réactions chimiques, notamment la décomposition du peroxyde d’hydrogène et les réactions d’oxydation.
- Adsorbant : Fe(OH)₃ sert de matériau adsorbant pour éliminer les impuretés, les contaminants et les colorants des solutions.
- Amendement du sol : Fe(OH)₃ agit comme un amendement du sol pour améliorer la fertilité du sol et la disponibilité des éléments nutritifs. Il améliore la capacité de rétention des nutriments du sol et fournit le fer essentiel à la croissance des plantes.
- Réactif de laboratoire : En laboratoire, les chercheurs et les analystes utilisent Fe(OH)₃ comme réactif à diverses fins d’analyse et de recherche, notamment les réactions de précipitation et l’ajustement du pH.
Les applications polyvalentes de Fe(OH)₃ mettent en évidence son importance dans différentes industries et sa contribution à divers processus allant des produits pharmaceutiques à l’assainissement de l’environnement.
Des questions:
Q : Quel est le poids correct de la formule d’hydroxyde de fer (III) ?
R : Le poids correct de la formule de Fe(OH)₃ est d’environ 106,867 g/mol.
Q : Quelle est l’équation ionique complète de la réaction entre FeBr3 et l’hydroxyde de baryum ?
R : L’équation ionique complète de la réaction entre FeBr3 et l’hydroxyde de baryum est FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
Q : Quelle masse de précipité d’hydroxyde de fer (III) peut être produite en faisant réagir 75,0 mL ?
R : Pour déterminer la masse du précipité Fe(OH)₃, des informations supplémentaires telles que la concentration ou la molarité des réactifs sont nécessaires.
Q : Comment former de l’hydroxyde de fer (III) ?
R : Fe(OH)₃ peut être formé par diverses méthodes, notamment des réactions de précipitation entre des sels de fer et des bases, l’oxydation de Fe(OH)2 ou l’hydrolyse d’une solution de sel de fer.
Q : L’hydroxyde de fer (III) est-il soluble ?
R : Non, Fe(OH)₃ n’est pas soluble dans l’eau. Il forme un précipité lorsqu’il est dissous dans l’eau.
Q : Combien de grammes de Fe(OH)₃ contiennent 4,61 grammes de Fe³⁺ ?
R : Pour déterminer les grammes de Fe(OH)₃, la masse molaire de Fe³⁺ et la stœchiométrie de la réaction sont nécessaires.
Q : De quelle couleur est Fe(OH)₃ ?
R : Fe(OH)₃ est généralement de couleur brune.
Q : L’hydroxyde de fer est-il un solide ?
R : Oui, l’hydroxyde de fer existe sous forme solide.
Q : Que produit l’hydroxyde de fer thermiquement décomposé ?
R : Le Fe(OH)₃ décomposé thermiquement produit de l’oxyde de fer (III) (Fe₂O₃) et de l’eau.
Q : L’hydroxyde de fer est-il soluble dans l’eau ?
R : Non, l’hydroxyde de fer n’est pas soluble dans l’eau. Il forme un précipité lorsqu’il est mélangé à l’eau.
