Le chlorure de thionyle est un composé chimique utilisé dans diverses applications industrielles. Il réagit avec les alcools et les acides carboxyliques, produisant respectivement les chlorures correspondants et le chlorure de sulfuryle.
| Nom de l’UICPA | Chlorure de thionyle |
| Formule moléculaire | SOCl₂ |
| Numero CAS | 7719-09-7 |
| Synonymes | Dichlorure sulfureux, Oxychlorure de soufre, Dichlorure de thionyle |
| InChI | InChI=1S/Cl2OS/c1-4(2)3 |
Propriétés du chlorure de thionyle
Formule de chlorure de thionyle
La formule du dichlorure de thionyle est SOCl₂, représentant un atome de soufre lié à deux atomes de chlore. C’est un composé chimique largement utilisé dans diverses industries.
Chlorure De Thionyle Masse molaire
Le dichlorure de thionyle a une masse molaire d’environ 118,97 grammes par mole. La masse molaire est déterminée en additionnant les masses atomiques de ses éléments constitutifs.
Point d’ébullition du chlorure de thionyle
Le dichlorure de thionyle a un point d’ébullition d’environ 79,6 degrés Celsius. Il s’agit de la température à laquelle la forme liquide du dichlorure de thionyle passe à l’état gazeux.
Point de fusion du chlorure de thionyle
Le point de fusion du dichlorure de thionyle est d’environ -104,5 degrés Celsius. Il s’agit de la température à laquelle la forme solide du dichlorure de thionyle passe à l’état liquide.
Densité du chlorure de thionyle g/mL
Le dichlorure de thionyle a une densité d’environ 1,64 grammes par millilitre. La densité est la mesure de la masse par unité de volume et constitue une caractéristique importante d’une substance.
Chlorure De Thionyle Poids moléculaire
Le poids moléculaire du dichlorure de thionyle est d’environ 118,97 grammes par mole. Il est calculé en additionnant les poids atomiques du soufre, du chlore et de l’oxygène.
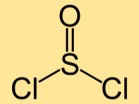
Structure du chlorure de thionyle
La structure du dichlorure de thionyle est constituée d’un atome de soufre lié à deux atomes de chlore. Les atomes de soufre et de chlore sont disposés linéairement, formant une molécule de forme courbée.
Solubilité du chlorure de thionyle
Le dichlorure de thionyle est peu soluble dans l’eau mais se dissout facilement dans les solvants organiques tels que le benzène, le toluène et le tétrachlorure de carbone. Sa solubilité est un facteur important dans ses applications.
| Apparence | Liquide incolore à jaune pâle |
| Gravité spécifique | 1,638 g/mL |
| Couleur | Incolore |
| Odeur | Piquant, suffocant |
| Masse molaire | 118,97 g/mole |
| Densité | 1,638 g/mL |
| Point de fusion | -104,5 °C |
| Point d’ébullition | 79,6 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit violemment |
| Solubilité | Soluble dans les solvants organiques tels que le benzène, le toluène et le tétrachlorure de carbone |
| Pression de vapeur | 4,33 kPa à 20 °C |
| Densité de vapeur | 3,9 (air = 1) |
| pKa | -6.3 |
| pH | N’est pas applicable |
Sécurité et dangers du chlorure de thionyle
Le dichlorure de thionyle présente plusieurs risques pour la sécurité et doit être manipulé avec précaution. Il est très corrosif et peut provoquer de graves brûlures au contact de la peau, des yeux ou des muqueuses. L’inhalation de ses vapeurs peut entraîner une irritation et des dommages respiratoires. Le composé réagit violemment avec l’eau, libérant des gaz toxiques, comme le chlorure d’hydrogène. Il doit donc être stocké et manipulé à l’écart des sources d’humidité. Le dichlorure de thionyle réagit également vigoureusement avec les alcools et les composés contenant de l’eau, ce qui peut entraîner des risques d’incendie ou d’explosion. Une ventilation adéquate, un équipement de protection individuelle et des pratiques de stockage appropriées sont essentiels pour garantir une manipulation sûre du dichlorure de thionyle.
| Symboles de danger | Corrosif (C), Toxique (T), Dangereux pour l’Environnement (N) |
| Description de la sécurité | – Tenir à l’écart des sources d’humidité et des substances incompatibles.<br>- Utiliser dans un endroit bien ventilé et porter un équipement de protection individuelle approprié.<br>- Manipuler avec précaution pour éviter tout contact avec la peau, les yeux et les muqueuses.<br> – Conserver dans un récipient bien fermé dans un endroit frais et sec. |
| Numéros d’identification de l’ONU | No ONU 1836 (Dichlorure de thionyle) |
| Code SH | 2812.10.00 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II (Modérément dangereux) |
| Toxicité | Très toxique par inhalation, ingestion et absorption cutanée.<br>- Peut provoquer de graves brûlures et une irritation respiratoire.<br>- Peut avoir des effets nocifs à long terme sur les organismes aquatiques. |
Méthodes de synthèse du chlorure de thionyle
Différentes méthodes permettent la synthèse du dichlorure de thionyle.
Une approche courante implique la réaction entre le trioxyde de soufre (SO₃) et le dichlorure de soufre (SCl₂) en présence d’un catalyseur comme le charbon actif ou le chlorure d’aluminium . La réaction se déroule à des températures élevées, généralement autour de 300 à 400 °C, et produit ainsi du dichlorure de thionyle.
Une autre méthode implique la réaction directe du dioxyde de soufre (SO₂) avec du pentachlorure de phosphore (PCl₅) ou de l’oxychlorure de phosphore (POCl₃). Cette réaction se déroule à reflux, avec addition progressive des réactifs, et conduit au dichlorure de thionyle.
La réaction du soufre avec le trichlorure de phosphore (PCl₃) donne du dichlorure de thionyle. Ce procédé consiste à chauffer les réactifs et à permettre la formation de dichlorure de thionyle.
Une autre méthode implique la réaction entre le pentasulfure de phosphore (P₂S₅) et le pentachlorure de phosphore (PCl₅) en présence d’un catalyseur acide de Lewis tel que le chlorure d’aluminium. La réaction se produit à des températures élevées et entraîne la formation de dichlorure de thionyle.
Il est important de noter que ces méthodes de synthèse nécessitent une manipulation appropriée et des précautions de sécurité en raison de la nature dangereuse des réactifs impliqués. La synthèse sûre et efficace du dichlorure de thionyle nécessite l’expertise de chimistes expérimentés et l’utilisation d’équipements de laboratoire appropriés.
Utilisations du chlorure de thionyle
Le dichlorure de thionyle trouve de nombreuses applications dans diverses industries en raison de ses propriétés chimiques polyvalentes. Voici quelques utilisations courantes du dichlorure de thionyle :
- Conversion des acides carboxyliques : le dichlorure de thionyle convertit les acides carboxyliques en chlorures d’acyle, en utilisant largement la réaction de Vilsmeier-Haack en synthèse organique.
- Chloration de l’alcool : le dichlorure de thionyle réagit avec les alcools, formant des chlorures d’alkyle et trouvant une application dans la production de composés chlorés pour les produits pharmaceutiques et agrochimiques, connue sous le nom de réaction de Darzens.
- Agent de déshydratation : Le dichlorure de thionyle agit comme un agent déshydratant, facilitant l’élimination de l’eau de divers composés. Il est couramment utilisé dans la synthèse de colorants, de parfums et d’intermédiaires pharmaceutiques.
- Fabrication de batteries au lithium-ion : les fabricants utilisent du dichlorure de thionyle pour produire des batteries au dichlorure de lithium-thionyle, qui présentent une densité énergétique élevée et une longue durée de conservation. Ces batteries ont des applications dans les appareils médicaux, les équipements militaires et les capteurs à distance.
- Réactions de polymérisation : Le dichlorure de thionyle participe aux réactions de polymérisation, contribuant à la synthèse de divers polymères, notamment les polycarbonates et les polyanhydrides.
- Composés du phosphore : Le dichlorure de thionyle réagit avec les composés du phosphore, tels que le trichlorure de phosphore, produisant des chlorures de phosphoryle. Les chimistes utilisent ces intermédiaires pour synthétiser des composés organophosphorés et des retardateurs de flamme.
- Réactif chimique : Le dichlorure de thionyle sert de réactif polyvalent dans de nombreuses transformations chimiques, notamment les réactions d’estérification, d’halogénation et de substitution nucléophile.
Des questions:
Q : Avec quoi peut-on rincer le chlorure de thionyle ?
R : Le dichlorure de thionyle peut être rincé avec un large excès d’alcool ou de base compatible, comme une solution de méthanol ou de bicarbonate de sodium.
Q : Quel est le produit de l’acide valérique avec le chlorure de thionyle ?
R : La réaction de l’acide valérique avec le dichlorure de thionyle produit du chlorure de valérile, ainsi que du dioxyde de soufre gazeux.
Q : Pouvez-vous ajouter du chlorure de thionyle avec un acide carboxylique ?
R : Oui, le dichlorure de thionyle peut être ajouté à un acide carboxylique pour le convertir en chlorure d’acyle par la réaction de Vilsmeier-Haack.
Q : Laquelle des formules suivantes est la formule de Lewis correcte pour le chlorure de thionyle (SOCl2) ?
R : La formule de Lewis correcte pour le dichlorure de thionyle (SOCl2) est représentée par S=O | Cl – Cl.
Q : Qu’est-ce qui motive la réaction du chlorure de thionyle ?
R : La réaction du dichlorure de thionyle est motivée par la réactivité élevée du chlorure de thionyle, qui agit comme électrophile dans diverses transformations chimiques.
Q : Comment éteindre le chlorure de thionyle ?
R : Le dichlorure de thionyle peut être trempé en ajoutant un agent de trempe approprié tel qu’un alcool primaire ou secondaire, ou en l’hydrolysant soigneusement avec de l’eau.
Q : Qu’obtiendriez-vous si vous mélangez des amines avec du chlorure de thionyle ?
R : Le mélange d’amines avec du dichlorure de thionyle entraîne la formation de sels de chlorhydrate d’amine correspondants.
Q : Qu’est-ce que le chlorure de thionyle ?
R : Le dichlorure de thionyle est un composé chimique de formule SOCl2, couramment utilisé comme réactif en synthèse organique et comme agent déshydratant.
Q : Que fera un excès de chlorure de thionyle ?
R : Un excès de dichlorure de thionyle peut entraîner des réactions vigoureuses, pouvant entraîner la production de gaz toxiques ou des risques d’explosion, et doit être manipulé avec prudence.
Q : Comment neutraliser le chlorure de thionyle ?
R : Le dichlorure de thionyle peut être neutralisé en l’ajoutant soigneusement à un large excès d’une base appropriée, telle que le bicarbonate de sodium ou l’hydroxyde de sodium, tout en garantissant des mesures de sécurité appropriées.
