Le chlorure de sulfuryle (SO2Cl2) est un composé formé par la combinaison de dioxyde de soufre et de chlore. Il est utilisé comme réactif dans les réactions chimiques et comme fumigant pour lutter contre les ravageurs.
| Nom UICPA | Chlorure de sulfuryle |
| Formule moléculaire | SO2Cl2 |
| Numero CAS | 7791-25-5 |
| Synonymes | Dichlorure sulfurique, Oxychlorure de soufre, Oxyde de dichlorure de soufre |
| InChI | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Propriétés du chlorure de sulfuryle
Formule de chlorure de sulfuryle
La formule chimique du dichlorure sulfurique est SO2Cl2. Il est dérivé de la combinaison d’un atome de soufre, de deux atomes d’oxygène et de deux atomes de chlore. Cette formule représente la composition et la disposition des atomes dans une molécule de dichlorure sulfurique.
Chlorure De Sulfuryle Masse molaire
La masse molaire du dichlorure sulfurique peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le dichlorure sulfurique a une masse molaire d’environ 134,97 grammes par mole. Cette valeur est importante pour divers calculs de réactions chimiques et de stœchiométrie.
Point d’ébullition du chlorure de sulfuryle
Le dichlorure sulfurique a un point d’ébullition d’environ 69 degrés Celsius. Lorsque la température dépasse ce point, le dichlorure sulfurique subit un changement de phase, passant d’un liquide à un gaz. Le point d’ébullition est un paramètre crucial pour déterminer les conditions dans lesquelles le dichlorure sulfurique peut être utilisé ou manipulé.
Point de fusion du chlorure de sulfuryle
Le point de fusion du dichlorure sulfurique est d’environ -54 degrés Celsius. À des températures inférieures à ce point, le dichlorure sulfurique passe de l’état solide à l’état liquide. Le point de fusion est important pour le stockage et la manipulation du dichlorure sulfurique car il indique les conditions dans lesquelles il se solidifie ou se liquéfie.
Densité du chlorure de sulfuryle g/mL
La densité du dichlorure sulfurique est d’environ 1,638 grammes par millilitre (g/mL). La densité représente la masse d’une substance par unité de volume et aide à déterminer son comportement physique. La densité du dichlorure sulfurique est importante pour comprendre sa flottabilité, sa solubilité et sa compatibilité avec d’autres substances.
Chlorure De Sulfuryle Poids moléculaire
Le poids moléculaire du dichlorure sulfurique est d’environ 134,97 unités de masse atomique (u). C’est la somme des masses atomiques des atomes constitutifs d’une molécule de dichlorure sulfurique. Le poids moléculaire fournit des informations cruciales pour divers calculs chimiques et pour déterminer la quantité de substance dans un échantillon donné.
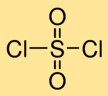
Structure du chlorure de sulfuryle
Le dichlorure sulfurique présente une structure moléculaire dans laquelle un atome de soufre est double-lié à deux atomes d’oxygène et simple-lié à deux atomes de chlore. Cet arrangement forme un atome central de soufre entouré d’atomes d’oxygène et de chlore, donnant au dichlorure sulfurique sa structure caractéristique.
Solubilité du chlorure de sulfuryle
Le dichlorure sulfurique est peu soluble dans l’eau. Il réagit avec l’eau pour produire de l’acide chlorhydrique et de l’acide sulfurique, ce qui le rend hydrolytiquement réactif. Cependant, le dichlorure sulfurique présente une certaine solubilité dans les solvants organiques tels que les hydrocarbures chlorés et les composés aromatiques, ce qui les rend adaptés à certaines applications.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,638 g/mL |
| Couleur | N / A |
| Odeur | Piquant, suffocant |
| Masse molaire | 134,97 g/mole |
| Densité | 1,638 g/mL |
| Point de fusion | -54 °C |
| Point d’ébullition | 69 °C |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Réagit vigoureusement |
| Solubilité | Soluble dans les solvants organiques tels que les hydrocarbures chlorés et les composés aromatiques |
| La pression de vapeur | 43,6 mmHg (à 25 °C) |
| Densité de vapeur | 4,43 (air = 1) |
| pKa | N / A |
| pH | N / A |
Sécurité et dangers du chlorure de sulfuryle
Le dichlorure sulfurique présente plusieurs risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. C’est une substance corrosive qui peut provoquer de graves brûlures à la peau, aux yeux et aux voies respiratoires au contact. L’inhalation directe de ses vapeurs peut entraîner une irritation respiratoire et des lésions pulmonaires. Il réagit violemment avec l’eau, libérant des gaz toxiques et présentant un risque d’explosion. Par conséquent, il est important de manipuler le dichlorure sulfurique dans un endroit bien ventilé et de porter un équipement de protection approprié, tel que des gants, des lunettes et une protection respiratoire. Les déversements doivent être immédiatement nettoyés en utilisant les procédures appropriées et le stockage doit se faire dans un endroit frais et sec, à l’écart des matières incompatibles.
| Symboles de danger | Corrosif (C), Comburant (O) |
| Description de la sécurité | Provoque de graves brûlures de la peau et des lésions oculaires. Réagit violemment avec l’eau. |
| Numéros d’identification de l’ONU | UN 1834 (Dichlorure sulfurique) |
| Code SH | 28121000 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II (Danger moyen) |
| Toxicité | Très toxique ; nocif en cas d’ingestion, d’inhalation ou d’absorption cutanée. |
Méthodes de synthèse du chlorure de sulfuryle
Les gens utilisent couramment quelques méthodes pour synthétiser le dichlorure sulfurique.
Une méthode implique la réaction entre le dioxyde de soufre (SO2) et le chlore gazeux (Cl2) . En présence d’un catalyseur, tel que du charbon actif ou du chlorure d’aluminium, les gaz réagissent pour former du dichlorure sulfurique (SO2Cl2). Cette réaction se produit généralement à des températures élevées, autour de 100 à 200°C.
Une autre méthode de synthèse du dichlorure sulfurique implique la réaction du trioxyde de soufre (SO3) avec du chlorure d’hydrogène (HCl). Dans des conditions contrôlées, ces deux composés se combinent pour produire du dichlorure sulfurique. Cette réaction est exothermique et se produit généralement en phase gazeuse.
Le procédé au chlorure de thionyle génère du dichlorure sulfurique par la réaction à température ambiante de l’acide sulfurique (H2SO4) avec le pentachlorure de phosphore (PCl5) . Cette réaction génère du dichlorure sulfurique ainsi que des sous-produits tels que l’acide phosphorique (H3PO4) et le chlorure d’hydrogène (HCl). Les milieux industriels utilisent couramment cette méthode.
Il est important de noter que ces méthodes de synthèse nécessitent une manipulation soigneuse des réactifs et la prise en compte des précautions de sécurité en raison de la réactivité et de la nature dangereuse des substances impliquées.
De plus, les chimistes utilisent souvent des équipements appropriés, tels que des condenseurs et des systèmes de reflux, pour contrôler les conditions de réaction et garantir une synthèse réussie du dichlorure sulfurique.
Utilisations du chlorure de sulfuryle
Le dichlorure sulfurique (SO2Cl2) trouve diverses applications dans différentes industries en raison de ses propriétés uniques. Voici quelques utilisations clés du dichlorure sulfurique :
- Réactif chimique : La synthèse organique utilise généralement le dichlorure sulfurique comme réactif chimique polyvalent, où il participe activement à diverses réactions, notamment la chloration, la sulfonation et l’estérification, permettant l’introduction de fonctionnalités chlore, soufre ou acide dans les composés organiques.
- Pesticide et fumigant : Le dichlorure sulfurique agit comme un fumigant puissant pour lutter contre les parasites dans les céréales stockées, les moulins à farine et les installations de transformation des aliments, éliminant activement les insectes, les larves et les ravageurs qui peuvent endommager les produits agricoles stockés en raison de ses fortes propriétés biocides.
- Polymérisation : Dans la polymérisation de monomères spécifiques, tels que le chlorure de vinyle, le dichlorure sulfurique sert de catalyseur ou d’initiateur actif, facilitant la production de polychlorure de vinyle (PVC), un polymère thermoplastique largement utilisé avec des applications dans les industries de la construction, de l’automobile et de l’électricité.
- Produits pharmaceutiques : le dichlorure sulfurique joue activement un rôle crucial dans la synthèse de composés pharmaceutiques, en particulier les sulfamides, qui sont des antibiotiques et des agents thérapeutiques essentiels utilisés pour traiter diverses infections.
- Fabrication de colorants : Le dichlorure sulfurique participe activement à la production de colorants, notamment ceux contenant du soufre ou du chlore. Il introduit activement les groupes fonctionnels souhaités et améliore la solidité des couleurs et la stabilité des colorants.
- Intermédiaires chimiques : le dichlorure sulfurique sert d’intermédiaire actif dans la synthèse d’autres produits chimiques, notamment le dioxyde de soufre, l’acide sulfurique et les chlorures de sulfonyle, qui trouvent des applications dans de nombreuses industries telles que la production de détergents, la fabrication de plastiques et les produits pharmaceutiques.
- Traitement de l’eau : Pour la purification et la désinfection de l’eau, le dichlorure sulfurique neutralise et élimine activement les bactéries nocives, les virus et autres micro-organismes présents dans les sources d’eau.
- Applications en laboratoire : Diverses procédures de laboratoire utilisent activement le dichlorure sulfurique, par exemple pour la détection et la détermination des amines primaires et secondaires. Il réagit activement avec les amines pour former des sulfamides stables, facilitant leur analyse et leur caractérisation.
Des questions:
Q : Quel est le nombre total de molécules-grammes de SO2Cl2 dans 13,5 g de chlorure de sulfuryle ?
R : Le nombre total de molécules-grammes de SO2Cl2 dans 13,5 g de chlorure de sulfuryle peut être calculé en divisant la masse donnée par la masse molaire de SO2Cl2.
Q : Le SO2Cl2 est-il polaire ou non polaire ?
R : SO2Cl2 est une molécule polaire en raison de la présence de liaisons polaires et d’une géométrie moléculaire asymétrique.
Q : À quel moment la pression du SO2Cl2 diminuera-t-elle ?
R : La baisse de pression du SO2Cl2 dépend de divers facteurs tels que la température, le volume et les conditions de réaction. Cela ne peut pas être déterminé uniquement en fonction du temps.
Q : Quelle est la pression partielle de SO2Cl2 dans ce mélange ?
R : La pression partielle de SO2Cl2 dans un mélange peut être déterminée à l’aide de la loi des gaz parfaits, en fonction de la température, du volume et de la fraction molaire ou de la concentration de SO2Cl2.
Q : Quel(s) type(s) de forces intermoléculaires sont attendus entre les molécules de SO2Cl2 ?
R : Les forces intermoléculaires attendues entre les molécules de SO2Cl2 incluent les interactions dipôle-dipôle et les forces de dispersion de Londres.
Q : À quel moment la pression partielle de SO2Cl2 diminuera-t-elle jusqu’au dixième de sa valeur initiale ?
R : Le temps nécessaire pour que la pression partielle de SO2Cl2 diminue jusqu’à un dixième de sa valeur initiale dépend des conditions spécifiques du système et de la vitesse de la réaction chimique impliquée.
Q : Quelle est la masse molaire du SO2Cl2 ?
R : La masse molaire du SO2Cl2 est d’environ 134,97 grammes par mole.
Q : Quelle est la géométrie moléculaire du SO2Cl2 ?
R : La géométrie moléculaire du SO2Cl2 est courbée ou en forme de V, avec un atome de soufre au centre lié à deux atomes d’oxygène et à deux atomes de chlore.
Q : Quelle est la structure de Lewis du SO2Cl2 ?
R : La structure de Lewis du SO2Cl2 est constituée d’un atome de soufre doublement lié à un atome d’oxygène et d’une simple liaison à un autre atome d’oxygène, avec deux atomes de chlore liés à l’atome de soufre.
