Le sulfate d’argent (Ag2SO4) est un solide blanc utilisé en photographie et en chimie analytique. Il se dissout dans l’eau et, lorsqu’il est chauffé, se décompose en oxyde d’argent et trioxyde de soufre.
| Nom UICPA | Sulfate d’argent |
| Formule moléculaire | Ag2SO4 |
| Numero CAS | 10294-26-5 |
| Synonymes | Sulfate d’argent, sulfate de disilver, argent acide sulfurique, monosulfate de disilver |
| InChI | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriétés du sulfate d’argent
Formule de sulfate d’argent
La formule chimique du sulfate de diargent est Ag2SO4. Il se compose de deux atomes d’argent (Ag) liés à un atome de soufre (S) et de quatre atomes d’oxygène (O). La formule représente le rapport des atomes dans une molécule de sulfate de diargent.
Sulfate D’Argent Masse molaire
La masse molaire du sulfate de diargent est calculée en additionnant les masses atomiques de ses éléments constitutifs. L’argent a une masse atomique de 107,87 grammes par mole (g/mol), le soufre a une masse atomique de 32,07 g/mol et l’oxygène a une masse atomique de 16,00 g/mol. En les additionnant, la masse molaire du sulfate de diargent est d’environ 311,81 g/mol.
Point d’ébullition du sulfate d’argent
Le sulfate de diargent n’a pas de point d’ébullition distinct car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il subit une décomposition thermique et se décompose en oxyde d’argent (Ag2O) et trioxyde de soufre (SO3). Par conséquent, le point d’ébullition du sulfate de diargent n’est pas applicable.
Sulfate d’argent Point de fusion
Le point de fusion du sulfate de diargent est d’environ 652 degrés Celsius (1 206 degrés Fahrenheit). À cette température, le sulfate de diargent passe de l’état solide à l’état liquide fondu. Il est important de noter que le point de fusion peut varier légèrement en fonction de la pureté de l’échantillon de sulfate de diargent.
Densité du sulfate d’argent g/mL
La densité du sulfate de diargent est d’environ 5,45 grammes par millilitre (g/mL). Cette valeur indique la masse de sulfate de diargent par unité de volume. La densité d’une substance dépend généralement de la température, il est donc important de prendre en compte les conditions lors de la mesure de la densité du sulfate de diargent.
Argent Sulfate Poids moléculaire
Le poids moléculaire du sulfate de diargent est calculé en additionnant les poids atomiques de ses éléments constitutifs, en tenant compte de la stœchiométrie de la formule. Dans le cas du sulfate de diargent (Ag2SO4), le poids moléculaire est d’environ 311,81 grammes par mole (g/mol).
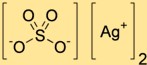
Structure du sulfate d’argent
Le sulfate de diargent a une structure cristalline composée de cations argent (Ag+) et d’anions sulfate (SO4^2-). Les cations argent sont entourés d’atomes d’oxygène provenant d’anions sulfate, formant un réseau tridimensionnel.
Solubilité du sulfate d’argent
Le sulfate de diargent est peu soluble dans l’eau. Il se dissout dans une mesure limitée, environ 0,8 gramme se dissolvant dans 100 millilitres d’eau à température ambiante. La solubilité peut être influencée par des facteurs tels que la température et la présence d’autres solutés dans la solution.
| Apparence | Solide blanc |
| Gravité spécifique | N / A |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 311,81 g/mole |
| Densité | 5,45 g/ml |
| Point de fusion | 652 °C (1 206 °F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Se dissout dans aq. acides, alcools, acétone, éther, acétates, amides |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | N / A |
Sécurité et dangers du sulfate d’argent
Le sulfate de diargent présente certains risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Il est important d’éviter l’inhalation, l’ingestion ou le contact avec la peau et les yeux. Lors de la manipulation du sulfate de diargent, il est conseillé de porter un équipement de protection individuelle approprié, notamment des gants, des lunettes et une blouse de laboratoire. En cas d’exposition accidentelle, rincer soigneusement les zones touchées avec de l’eau. Le sulfate de diargent peut provoquer une irritation de la peau et des yeux, et une exposition prolongée ou répétée peut entraîner une sensibilisation. Il est également nécessaire de manipuler le sulfate de diargent dans un endroit bien ventilé pour minimiser le risque d’inhalation. Des procédures appropriées de stockage, d’étiquetage et d’élimination doivent être suivies pour garantir la sécurité.
| Symboles de danger | Aucun symbole |
| Description de la sécurité | Évitez l’inhalation, l’ingestion et le contact avec la peau et les yeux. Portez un EPI. Manipuler dans un endroit bien ventilé. Stockage, étiquetage et élimination appropriés. |
| Numéros d’identification de l’ONU | N / A |
| Code SH | 28429090 |
| Classe de danger | N / A |
| Groupe d’emballage | N / A |
| Toxicité | Irritant pour la peau et les yeux. Une exposition prolongée/répétée peut provoquer une sensibilisation. |
Méthodes de synthèse du sulfate d’argent
Il existe plusieurs méthodes pour synthétiser le sulfate de diargent.
Une méthode courante implique la réaction entre le nitrate d’argent (AgNO3) et l’acide sulfurique (H2SO4) . En laboratoire, tout en remuant, les scientifiques ajoutent lentement du nitrate d’argent à une solution d’acide sulfurique, entraînant la formation d’un précipité blanc appelé sulfate de diargent. Ils récupèrent le précipité, le lavent et le sèchent pour obtenir du sulfate de diargent pur.
Les scientifiques obtiennent également du sulfate de diargent en ajoutant de l’oxyde d’argent (Ag2O) à l’acide sulfurique et en chauffant le mélange tout en remuant. Ce processus produit du sulfate de diargent sous forme de précipité, qu’ils filtrent, lavent et sèchent pour obtenir le produit final.
De plus, les scientifiques peuvent obtenir du sulfate de diargent en chauffant un mélange de chlorure d’argent (AgCl) et d’acide sulfurique concentré. Ils ajoutent le chlorure d’argent à l’acide sulfurique et appliquent de la chaleur au mélange. La réaction conduit à la formation de sulfate de diargent sous forme de précipité, qui peut être collecté, lavé et séché.
Il est important de noter que ces méthodes de synthèse doivent être réalisées avec des précautions de sécurité appropriées, notamment l’utilisation d’un équipement de protection approprié et le travail dans un endroit bien ventilé.
Utilisations du sulfate d’argent
Le sulfate de disilver a plusieurs utilisations dans différents domaines en raison de ses propriétés uniques. Voici quelques-unes de ses applications courantes :
- Photographie : en photographie noir et blanc, les photographes utilisent le sulfate de diargent comme composant d’émulsions photosensibles pour capturer et développer des images en réagissant avec la lumière.
- Chimie analytique : diverses méthodes analytiques utilisent le sulfate de diargent comme réactif pour détecter et quantifier les halogénures, tels que les ions chlorure et bromure, par le biais de réactions de précipitation.
- Galvanoplastie : les processus de galvanoplastie utilisent du sulfate de diargent pour déposer une couche d’argent sur des surfaces conductrices, créant ainsi des revêtements décoratifs ou protecteurs sur les bijoux, les appareils électroniques et d’autres objets.
- Agent antimicrobien : En raison de ses propriétés antimicrobiennes, le sulfate de diargent trouve une application dans la formulation de pansements, de pommades et de dispositifs médicaux. Il aide à prévenir les infections et favorise la guérison.
- Industrie des batteries : L’industrie des batteries l’utilise comme composant crucial dans le matériau des électrodes pour la fabrication des batteries argent-zinc et argent-cadmium, qui sont répandues dans les appareils électroniques et les équipements médicaux.
- Réactif de laboratoire : Le sulfate de diargent sert de réactif dans diverses expériences de laboratoire, notamment la synthèse d’autres composés d’argent et dans des réactions de chimie organique.
- Fabrication du verre : Dans la fabrication du verre, elle joue un rôle essentiel dans la production de verres spécialisés, notamment des miroirs argentés et des revêtements conducteurs pour fenêtres. Les fabricants appliquent une fine couche de sulfate de diargent pour obtenir ces propriétés souhaitées.
- Catalyseur : Le sulfate de diargent agit comme un catalyseur dans certaines réactions chimiques, notamment les réactions d’oxydation et les processus de polymérisation.
Des questions:
Q : Qu’est-ce qui est produit d’autre lors de la réaction de remplacement du nitrate d’argent et du sulfate de potassium ?
R : Lors de la réaction de remplacement de AgNO3 et K2SO4, les produits formés sont le nitrate de potassium (KNO3) et le sulfate de diargent (Ag2SO4).
Q : Si du sulfate d’argent solide supplémentaire est ajouté à la solution, est-ce qu’il se dissoudra ?
R : Oui, du sulfate de diargent solide supplémentaire se dissoudra dans la solution, car il est peu soluble dans l’eau.
Q : Des précipitations se produisent-elles lorsque du nitrate d’argent + du sulfate de sodium ?
R : Oui, la précipitation se produit lorsque AgNO3 réagit avec le sulfate de sodium, entraînant la formation d’un précipité Ag2SO4 solide.
Q : Quel est le pourcentage d’argent dans le sulfate d’argent ?
R : Le pourcentage d’Ag dans le sulfate de diargent est d’environ 63,48 %.
Q : Le sulfate d’argent est-il soluble ou insoluble ?
R : Le sulfate de diargent est peu soluble dans l’eau.
Q : Comment trouver la formule chimique du sulfate d’argent ?
R : La formule chimique du sulfate de diargent est Ag2SO4, qui peut être déterminée en fonction de la valence du cation Ag+ et de l’anion SO4-2.
Q : Quelle est la couleur de l’Ag2SO4 ?
R : Le sulfate de diargent (Ag2SO4) est un solide blanc.
Q : Quelle est la valeur de Ksp pour Ag2SO4 si 5,49 g sont solubles dans 1,00 L d’eau ?
R : La valeur de la constante du produit de solubilité (Ksp) pour Ag2SO4 peut être calculée à l’aide des informations fournies, mais cela nécessite des données supplémentaires sur la dissociation de Ag2SO4 dans l’eau.
Q : Quelle est la masse molaire d’Ag2SO4 ?
R : La masse molaire d’Ag2SO4 est d’environ 311,81 g/mol.
Q : Est-ce qu’un Ag2SO4 solide se forme lorsque 2,7 g sont dissous dans 100 ml d’eau ?
R : Oui, un peu d’Ag2SO4 solide peut se former lorsqu’il dépasse la limite de solubilité du sulfate de diargent dans 100 ml d’eau.
