L’oxyde de nickel (II) est un composé chimique de formule NiO. C’est un solide noir, couramment utilisé comme catalyseur et dans la production de céramiques et de pigments.
| Nom UICPA | Oxyde de nickel(II) |
| Formule moléculaire | NiO |
| Numero CAS | 1313-99-1 |
| Synonymes | Oxyde de nickel, monoxyde de nickel, oxyde de Ni(II) |
| InChI | InChI=1S/Ni.O |
Propriétés de l’oxyde de nickel (II)
Formule d’oxyde de nickel (II)
La formule chimique du monoxyde de nickel est NiO. Il se compose d’un atome de nickel (Ni) et d’un atome d’oxygène (O), ce qui donne une formule simple et directe.
Oxyde De Nickel(II) Masse molaire
La masse molaire du monoxyde de nickel peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour NiO, la masse molaire est d’environ 74,69 grammes par mole (g/mol).
Point d’ébullition de l’oxyde de nickel (II)
Le monoxyde de nickel n’a pas de point d’ébullition distinct car il subit une décomposition avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il se décompose en ses éléments constitutifs, le nickel et l’oxygène.
Oxyde de nickel(II) Point de fusion
Le point de fusion du monoxyde de nickel est d’environ 1984 degrés Celsius (1984 °C). A cette température, le NiO solide se transforme à l’état liquide.
Densité de l’oxyde de nickel (II) g/mL
La densité du monoxyde de nickel est d’environ 6,67 grammes par millilitre (g/mL). Cette valeur indique la quantité de masse emballée dans un volume donné, ce qui en fait une mesure de la compacité de la substance.
Oxyde De Nickel(II) Poids moléculaire
Le poids moléculaire du monoxyde de nickel est calculé en additionnant les poids atomiques de ses éléments constitutifs. Pour NiO, le poids moléculaire est d’environ 74,69 grammes par mole (g/mol).
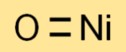
Structure d’oxyde de nickel (II)
Le monoxyde de nickel possède une structure cristalline cubique. Il se compose d’ions nickel (Ni2+) et d’ions oxyde (O2-) disposés selon un motif régulier et répétitif. Cette structure contribue à ses propriétés et à son comportement caractéristiques.
Solubilité de l’oxyde de nickel (II)
Le monoxyde de nickel est peu soluble dans l’eau. Il présente une solubilité limitée, ce qui signifie qu’il ne se dissout que dans une faible mesure dans l’eau. Cependant, il peut réagir avec les acides pour former des sels de nickel solubles, présentant un certain degré de réactivité chimique.
| Apparence | Noir solide |
| Gravité spécifique | 6,67 g/ml |
| Couleur | Noir |
| Odeur | Inodore |
| Masse molaire | 74,69 g/mole |
| Densité | 6,67 g/ml |
| Point de fusion | 1984 °C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les acides, forme des sels de nickel solubles |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | Neutre |
Veuillez noter que certaines propriétés, telles que le point d’éclair, la pression de vapeur et le pKa, ne sont pas applicables ou disponibles pour le monoxyde de nickel.
Sécurité et dangers de l’oxyde de nickel (ii)
Le monoxyde de nickel présente certaines considérations de sécurité et certains dangers. Il est important de le manipuler avec précaution. Le contact direct avec la peau, les yeux ou l’inhalation de ses poussières ou vapeurs doit être évité. Cela peut provoquer une irritation cutanée et des réactions allergiques chez certaines personnes. En cas d’ingestion ou d’inhalation, des soins médicaux immédiats sont nécessaires. le monoxyde de nickel n’est pas considéré comme hautement inflammable mais peut contribuer à un incendie s’il est exposé à des matériaux combustibles. Il est important de le stocker et de le manipuler dans un endroit bien aéré. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lorsque vous travaillez avec du monoxyde de nickel afin de minimiser les risques potentiels.
| Symboles de danger | Aucun |
| Description de la sécurité | Manipuler avec soin. Évitez le contact direct et l’inhalation. Utilisez un équipement de protection approprié. Obtenez des soins médicaux si nécessaire. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2825.70.10 |
| Classe de danger | Non classés |
| Groupe d’emballage | Non classés |
| Toxicité | Considéré comme nocif en cas d’ingestion ou d’inhalation. Peut provoquer une irritation cutanée et des réactions allergiques. |
Veuillez noter que le monoxyde de nickel ne porte pas de symboles de danger spécifiques, d’identifiants ONU, de classe de danger ou de groupe d’emballage. Les informations de sécurité fournies sont basées sur les connaissances générales et les précautions associées à la manipulation et à l’utilisation du monoxyde de nickel. Il est essentiel de se référer aux fiches de données de sécurité (FDS) spécifiques et de suivre les pratiques de sécurité recommandées pour obtenir des informations précises et détaillées.
Méthodes de synthèse de l’oxyde de nickel (ii)
Il existe plusieurs méthodes pour synthétiser le monoxyde de nickel. Une approche courante est la décomposition thermique des composés du nickel, tels que le carbonate de nickel ou l’hydroxyde de nickel. Dans cette méthode, chauffer un composé précurseur spécifique en l’absence d’oxygène pour former du monoxyde de nickel.
Une autre méthode implique l’oxydation du nickel métallique. Le nickel métallique peut réagir avec l’oxygène ou l’air à des températures élevées pour produire du monoxyde de nickel. Effectuez ce processus en calcinant ou en grillant du nickel métallique dans une atmosphère d’air ou d’oxygène pour produire du monoxyde de nickel.
Utilisez des réactions de précipitation pour synthétiser le monoxyde de nickel en faisant réagir des sels de nickel, tels que le chlorure de nickel ou le nitrate de nickel, avec une solution alcaline comme l’hydroxyde de sodium ou l’hydroxyde d’ammonium . Cette réaction forme un précipité de monoxyde de nickel.
La synthèse sol-gel est une autre méthode viable. Cela implique l’hydrolyse et la condensation de précurseurs de nickel appropriés, tels que les alcoxydes de nickel, dans une solution. Obtenir du monoxyde de nickel en séchant et en calcinant le gel formé lors de la réaction de précipitation.
Utiliser des techniques d’électrodéposition pour la synthèse du monoxyde de nickel. En appliquant un courant électrique à une électrode de nickel immergée dans une solution électrolytique, du monoxyde de nickel peut se former à la surface de l’électrode.
Lors du choix d’une méthode de synthèse, il convient de prendre en compte des facteurs tels que la pureté souhaitée, l’évolutivité et les exigences spécifiques de l’application, car chaque méthode offre ses propres avantages.
Utilisations de l’oxyde de nickel (ii)
Le monoxyde de nickel trouve diverses utilisations dans différentes industries en raison de ses propriétés uniques. Voici quelques-unes de ses applications courantes :
- Catalyseur : Le monoxyde de nickel catalyse activement diverses réactions chimiques, telles que les processus d’hydrogénation et d’oxydation, facilitant la conversion des réactifs en produits souhaités.
- Céramiques : Dans la production de matériaux céramiques, le monoxyde de nickel fonctionne activement comme agent colorant, contribuant activement à l’obtention de couleurs et de motifs spécifiques dans les émaux et pigments céramiques.
- Piles : les piles rechargeables au nickel-cadmium (NiCd) et au nickel-hydrure métallique (NiMH) utilisent activement le monoxyde de nickel comme matériau d’électrode positive, permettant activement le stockage et la libération de l’énergie électrique.
- Capteurs de gaz : le monoxyde de nickel détecte activement les gaz tels que le monoxyde de carbone (CO) et le dioxyde d’azote (NO2) dans les applications de détection de gaz lorsqu’il est utilisé dans des capteurs basés sur celui-ci.
- Fabrication du verre : L’industrie du verre utilise activement le monoxyde de nickel pour conférer diverses couleurs aux produits en verre, contribuant ainsi activement à la production de verre coloré, notamment de nuances vertes, brunes et noires.
- Revêtements conducteurs : le monoxyde de nickel fonctionne activement comme composant dans les revêtements conducteurs, qui rendent activement conducteurs des matériaux comme le verre ou les plastiques lorsqu’ils leur sont appliqués.
- Piles à combustible : le monoxyde de nickel fonctionne activement comme composant des piles à combustible à oxyde solide (SOFC), agissant activement comme matériau cathodique et participant aux réactions électrochimiques au sein de la pile à combustible.
- Support de catalyseur : le monoxyde de nickel sert activement de matériau de support pour d’autres catalyseurs, améliorant activement leur stabilité et leurs performances.
La gamme diversifiée d’applications du monoxyde de nickel souligne son importance dans diverses industries, soulignant son utilité et sa polyvalence.
Des questions:
Q : Quelle est la formule de l’oxyde de nickel (II) ?
R : La formule de l’oxyde de nickel (II) est NiO.
Q : Quel sel se forme lors de la réaction de l’oxyde de nickel (II) avec l’acide nitrique ?
R : La réaction de l’oxyde de nickel (II) avec l’acide nitrique forme du nitrate de nickel (II) (Ni (NO3) 2).
Q : À quelle tension le nickel(II) s’oxyde-t-il en nickel(III) ?
R : Le nickel (II) s’oxyde en nickel (III) à une tension d’environ +1,63 V.
Q : Que se passe-t-il lorsque le Ni(s) est oxydé en ion nickel(II), comme le montre l’image ?
R : Lors de l’oxydation du Ni(s) en ion nickel(II), des électrons sont perdus, entraînant la formation d’ions Ni2+.
Q : Quelles masses d’oxyde de nickel(II) et d’aluminium doivent être utilisées pour produire 13,3 g de nickel ?
R : Les masses d’oxyde de nickel (II) et d’aluminium nécessaires pour produire 13,3 g de nickel dépendent de la réaction spécifique et de la stœchiométrie impliquée.
