L’hydroxyde de nickel (Ni(OH)2) est un composé chimique composé d’ions nickel et hydroxyde. Il est couramment utilisé comme précurseur des batteries à base de nickel.
| Nom de l’UICPA | Hydroxyde de nickel |
| Formule moléculaire | Ni(OH)2 |
| Numero CAS | 12054-48-7 |
| Synonymes | Hydroxyde de nickel(II); Hydroxyde de nickel ; Trioxyde de diazote et de nickel (2+) |
| InChI | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Propriétés de l’hydroxyde de nickel
Formule d’hydroxyde de nickel
La formule de l’hydroxyde de nickel est Ni(OH)2. Il se compose d’un ion nickel (Ni) et de deux ions hydroxyde (OH-). Cette formule chimique représente la composition de l’hydroxyde de nickel au niveau atomique.
Hydroxyde De Nickel Masse molaire
La masse molaire de Ni(OH)2 est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le nickel a une masse atomique de 58,6934 g/mol et chaque ion hydroxyde a une masse de 17,007 g/mol. En les additionnant, la masse molaire de Ni(OH)2 est d’environ 92,6934 g/mol.
Point d’ébullition de l’hydroxyde de nickel
Ni(OH)2 n’a pas de point d’ébullition bien défini car il se décompose lorsqu’il est chauffé. À des températures élevées, il subit une décomposition thermique et se transforme en oxyde de nickel (NiO) et en vapeur d’eau.
Point de fusion de l’hydroxyde de nickel
Le point de fusion du Ni(OH)2 est d’environ 230°C. À cette température, Ni(OH)2 subit un changement de phase de l’état solide à l’état liquide. Le composé fond, permettant d’autres réactions chimiques ou traitements.
Densité d’hydroxyde de nickel g/mL
La densité de Ni(OH)2 est d’environ 4,1 g/mL. Cette valeur représente la masse du composé par unité de volume. Il indique la compacité ou la concentration de Ni(OH)2 dans un espace donné.
Hydroxyde De Nickel Poids moléculaire
Le poids moléculaire de Ni(OH)2 est déterminé en additionnant les poids atomiques de ses éléments constitutifs. Le nickel a un poids atomique de 58,6934 g/mol et chaque ion hydroxyde pèse 17,007 g/mol. Ainsi, le poids moléculaire de Ni(OH)2 est d’environ 92,6934 g/mol.
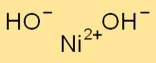
Structure de l’hydroxyde de nickel
Ni(OH)2 cristallise dans le système cristallin hexagonal. Il forme des couches d’ions Ni+2 et OH- empilées les unes sur les autres. Les ions Ni+2 sont entourés d’ions OH- de manière coordonnée, créant une structure en réseau.
Solubilité de l’hydroxyde de nickel
Ni(OH)2 est peu soluble dans l’eau. Il se dissout dans une certaine mesure, formant une solution légèrement alcaline en raison de la présence d’ions hydroxyde. La solubilité du Ni(OH)2 peut être influencée par des facteurs tels que la température et le pH.
| Apparence | Solide vert |
| Gravité spécifique | 4,1 g/ml |
| Couleur | Vert |
| Odeur | Inodore |
| Masse molaire | 92,6934 g/mole |
| Densité | 4,1 g/ml |
| Point de fusion | 230°C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Légèrement soluble |
| Solubilité | Insoluble, forme une solution alcaline dans l’eau |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | Alcalin |
Sécurité et dangers de l’hydroxyde de nickel
Le Ni(OH)2 présente certains risques pour la sécurité qui doivent être pris en compte. Il peut irriter la peau, les yeux et le système respiratoire par contact ou par inhalation. Une exposition prolongée ou répétée peut entraîner une sensibilisation, provoquant des réactions allergiques. Il est important de manipuler le Ni(OH)2 avec précaution, en utilisant des mesures de protection appropriées telles que des gants, des lunettes et un respirateur. En cas d’ingestion ou d’exposition accidentelle, des soins médicaux immédiats doivent être recherchés. De plus, le Ni(OH)2 est considéré comme un danger pour l’environnement et doit être éliminé de manière appropriée conformément à la réglementation afin de prévenir la contamination du sol ou des sources d’eau.
| Symboles de danger | Aucun |
| Description de la sécurité | – Peut provoquer une irritation de la peau et des yeux\n- Peut provoquer une irritation respiratoire\n- Sensibilisation possible\n- Suivre les procédures de manipulation et d’élimination appropriées |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2825.70.10 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Considéré comme une toxicité faible à modérée |
Veuillez noter que les symboles de danger et les identifiants ONU ne s’appliquent pas au Ni(OH)2 car il n’est pas classé comme substance dangereuse. La description de sécurité fournie met en évidence les risques potentiels et les précautions associés à la manipulation du Ni(OH)2. La toxicité du Ni(OH)2 est généralement considérée comme faible à modérée.
Méthodes de synthèse de l’hydroxyde de nickel
Il existe plusieurs méthodes de synthèse disponibles pour la production de Ni(OH)2. Une méthode courante implique la réaction entre un sel de nickel soluble, tel que le sulfate de nickel ou le nitrate de nickel, et un hydroxyde alcalin, généralement l’hydroxyde de sodium ou l’hydroxyde de potassium. La réaction se déroule dans une solution aqueuse dans des conditions contrôlées, entraînant la formation de Ni(OH)2 sous forme de précipité.
Dans la méthode de dépôt électrochimique, la cellule électrolytique utilise du nickel métallique comme électrode. Il applique un courant électrique approprié pour réduire les ions nickel de l’électrolyte et les déposer sur l’électrode sous forme de Ni(OH)2. Cette méthode permet un contrôle précis de la composition et de la morphologie du Ni(OH)2 résultant.
La décomposition thermique des sels de nickel permet la production de Ni(OH)2. En chauffant un sel de nickel, tel que le carbonate de nickel ou Ni(OH)2 lui-même, dans un environnement contrôlé, le composé subit une décomposition, produisant du Ni(OH)2 ainsi que d’autres sous-produits.
Il convient de mentionner que le choix de la méthode de synthèse dépend de facteurs tels que la pureté souhaitée, la taille des particules et les exigences spécifiques de l’application. Lors de la sélection de la voie de synthèse appropriée pour la production de Ni(OH)2, il faut soigneusement considérer le résultat souhaité en raison des avantages et des limites associés à chaque méthode.
Utilisations de l’hydroxyde de nickel
Ni(OH)2 trouve diverses applications en raison de ses propriétés uniques. Voici quelques utilisations courantes du Ni(OH)2 :
- Fabrication de batteries : le Ni(OH)2 joue un rôle crucial en tant que matériau de cathode dans les batteries à base de nickel, telles que les batteries au nickel-cadmium (NiCd) et au nickel-hydrure métallique (NiMH). Il stocke et libère de l’énergie électrique, permettant un stockage efficace de l’énergie.
- Catalyseur : Ni(OH)2 agit comme catalyseur dans diverses réactions chimiques, notamment les processus d’hydrogénation et d’oxydation. Ses propriétés catalytiques facilitent la conversion efficace des réactifs en produits souhaités.
- Galvanoplastie : Ni(OH)2 forme une couche de nickel stable et adhérente, ce qui la rend précieuse dans les applications de galvanoplastie. Il fournit un revêtement protecteur, résistant à la corrosion et esthétiquement attrayant sur différentes surfaces métalliques.
- Pigments : les fabricants utilisent le Ni(OH)2 comme pigment vert dans la production de céramique, de verre et de plastiques. Sa couleur verte vibrante rehausse la valeur esthétique de ces matériaux.
- Capteurs de gaz : les capteurs à base de Ni(OH)2 détectent et surveillent des gaz comme l’hydrogène, l’ammoniac et le sulfure d’hydrogène. Les changements de conductivité électrique dans les films de Ni(OH)2 permettent la détection efficace de ces gaz.
- Traitement de l’eau : Le Ni(OH)2 facilite les processus de traitement de l’eau en adsorbant et en éliminant sélectivement les contaminants de métaux lourds, tels que le plomb et le cadmium. Il présente une affinité pour ces métaux, ce qui le rend utile pour leur élimination des sources d’eau.
- Applications pharmaceutiques : Le Ni(OH)2 trouve une application dans les formulations pharmaceutiques, servant de liant, de désintégrant ou de régulateur de pH dans les formulations de comprimés ou de capsules.
Ce ne sont là que quelques exemples des diverses applications du Ni(OH)2, démontrant sa polyvalence et son importance dans diverses industries.
Des questions:
Q : Quelle est la formule chimique de l’hydroxyde de nickel (II) de base ?
R : La formule chimique de l’hydroxyde de nickel (II) est Ni(OH)2.
Q : L’hydroxyde de nickel est-il soluble dans l’eau ?
R : Ni(OH)2 est insoluble dans l’eau.
Q : Combien de grammes de chlorure de nickel (II) sont nécessaires pour neutraliser 75,0 ml d’hydroxyde de lithium 0,555 M ?
R : Les grammes de chlorure de nickel requis peuvent être calculés en utilisant la stœchiométrie et la molarité de la solution d’hydroxyde de lithium.
Q : Quelle charge représente Ni(OH)2 ?
R : La charge de Ni(OH)2 est neutre ou nulle.
Q : Comment calculer la solubilité molaire du Ni(OH)2 ?
R : La solubilité molaire du Ni(OH)2 peut être déterminée en divisant le nombre de moles de composé dissous par le volume de la solution.
Q : Quelle est la forme équilibrée de l’équation NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s) ?
R : L’équation équilibrée est 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
Q : Combien de grammes par mole représente Ni(OH)2 ?
R : La masse molaire de Ni(OH)2 est d’environ 92,6934 g/mol.
Q : Le Ni(OH)2 est-il soluble dans l’eau ?
R : Non, Ni(OH)2 est insoluble dans l’eau.
Q : Quel est l’agent réducteur dans la réaction : Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2 ?
R : L’agent réducteur dans la réaction est le magnésium (Mg).
Q : Le Ni(OH)2 est-il un solide ?
R : Oui, Ni(OH)2 est un composé solide.
Q : Si la cellule a un potentiel de 0,247 V à 25°C, quel est le Ksp de Ni(OH)2 ?
R : Le Ksp de Ni(OH)2 peut être déterminé à l’aide de l’équation de Nernst et du potentiel cellulaire.
Q : Quels sels seront plus solubles dans une solution acide que dans l’eau pure ?
R : Les sels comme Ni(OH)2 seront plus solubles dans une solution acide en raison de la réaction de neutralisation avec l’acide.
