Le trichlorure de bore (BCl3) est un composé comportant trois atomes de chlore liés à un atome de bore. Il est utilisé dans divers procédés industriels, tels que les catalyseurs et comme réactif en synthèse organique.
| Nom UICPA | Trichlorure de bore |
| Formule moléculaire | BCl3 |
| Numero CAS | 10294-34-5 |
| Synonymes | Trichloroborane; Chlorure de bore (III), trichloro-borane, trichlorobore |
| InChI | InChI=1S/BCl3/c2-1(3)4 |
Propriétés du trichlorure de bore
Formule de trichlorure de bore
La formule du chlorure de bore est BCl3, représentant un atome de bore lié à trois atomes de chlore. Il s’agit d’une formule moléculaire simple et directe qui décrit la composition de ce composé.
Trichlorure De Bore Masse molaire
La masse molaire du chlorure de bore peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le bore a une masse atomique d’environ 10,81 grammes par mole et chaque atome de chlore a une masse atomique d’environ 35,45 grammes par mole. Par conséquent, la masse molaire de BCl3 est d’environ 117,17 grammes par mole.
Point d’ébullition du trichlorure de bore
Le chlorure de bore a un point d’ébullition relativement bas par rapport à de nombreux autres composés. Il bout à environ -15,7 degrés Celsius ou 3,77 degrés Fahrenheit. Cela signifie qu’à des températures supérieures à ce point, le chlorure de bore passe d’une phase liquide à une phase gazeuse.
Trichlorure de bore Point de fusion
Le point de fusion du chlorure de bore est relativement bas. Il fond à environ -107,5 degrés Celsius ou -161,5 degrés Fahrenheit. À des températures inférieures à ce point, le composé passe de l’état solide à l’état liquide.
Densité du trichlorure de bore g/mL
La densité du chlorure de bore est d’environ 1,38 grammes par millilitre. Cette valeur indique la masse du composé par unité de volume. Il est utile pour déterminer le comportement du chlorure de bore dans diverses applications et comprendre ses propriétés physiques.
Trichlorure De Bore Poids moléculaire
Le poids moléculaire du chlorure de bore est d’environ 117,17 grammes par mole. Cette valeur représente la somme des masses atomiques de tous les atomes d’une molécule du composé et est utile pour divers calculs, tels que la détermination de la quantité de chlorure de bore dans un échantillon donné.
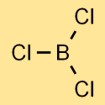
Structure du trichlorure de bore
Le chlorure de bore a une structure moléculaire planaire trigonale. Il se compose d’un atome de bore au centre lié à trois atomes de chlore, disposés en forme triangulaire. Cette structure contribue aux propriétés physiques et chimiques du composé.
Solubilité du trichlorure de bore
Le chlorure de bore présente une faible solubilité dans l’eau. Il est peu soluble, ce qui signifie qu’il ne se dissout que dans une mesure limitée dans les solutions aqueuses. Cependant, il est plus soluble dans les solvants organiques tels que le benzène et le tétrachlorure de carbone. La solubilité du chlorure de bore influence son comportement dans différentes réactions chimiques et procédés industriels.
| Apparence | Gaz incolore |
| Gravité spécifique | 1,369 g/mL |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 117,17 g/mole |
| Densité | 1,38 g/ml |
| Point de fusion | -107,5°C |
| Point d’ébullition | -15,7°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit |
| Solubilité | Soluble dans les solvants organiques tels que le benzène et le tétrachlorure de carbone |
| La pression de vapeur | 623 mmHg à 20°C |
| Densité de vapeur | 3,24 (air = 1) |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du trichlorure de bore
Le chlorure de bore soulève plusieurs considérations de sécurité et de danger. Il est corrosif et peut provoquer de graves brûlures à la peau, aux yeux et aux voies respiratoires au contact. L’inhalation de ses vapeurs peut entraîner une irritation respiratoire et des lésions pulmonaires. Le composé est également très réactif avec l’eau, libérant du gaz toxique de chlorure d’hydrogène. Il est essentiel de manipuler le chlorure de bore avec prudence, en utilisant un équipement de protection individuelle approprié et en assurant une ventilation adéquate. En cas d’exposition accidentelle, des soins médicaux immédiats sont nécessaires. De plus, des procédures appropriées de stockage et de manipulation doivent être suivies pour éviter les risques d’incendie, d’explosion et de dégagement de gaz dangereux.
| Symboles de danger | Corrosif (C) |
| Description de la sécurité | Porter des gants de protection/un équipement de protection des yeux/du visage. Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Manipuler dans un endroit bien ventilé. |
| Numéros d’identification de l’ONU | UN1741 |
| Code SH | 2827390000 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II |
| Toxicité | Très toxique par ingestion ou inhalation. Peut provoquer de graves brûlures et une irritation respiratoire. Manipuler avec une extrême prudence. |
Méthodes de synthèse du trichlorure de bore
Une méthode de synthèse du chlorure de bore implique la réaction entre l’oxyde de bore (B2O3 ) et le tétrachlorure de carbone (CCl4) en présence d’un catalyseur comme le chlorure d’aluminium (AlCl3) . Le B2O3 et le CCl4 réagissent à des températures élevées, produisant du chlorure de bore et du dioxyde de carbone comme sous-produits.
Une autre approche est la réaction directe entre le bore et le chlore gazeux. Dans des conditions contrôlées, le bore réagit avec le chlore, entraînant la formation de chlorure de bore. Cette méthode nécessite une manipulation prudente du chlore gazeux en raison de sa nature dangereuse.
Le chlorure de thionyle (SOCl2) permet la synthèse du chlorure de bore en faisant réagir le bore avec SOCl2 à des températures élevées, entraînant la production de chlorure de bore et de dioxyde de soufre gazeux.
Ces méthodes de synthèse offrent des voies viables pour la fabrication de chlorure de bore, tant en laboratoire qu’en milieu industriel. Il est crucial de garantir des mesures de sécurité appropriées pendant la synthèse, comme travailler dans des zones bien ventilées et utiliser un équipement de protection approprié. Ceci est important en raison de la nature dangereuse des réactifs et des produits impliqués dans le processus.
Écrire les utilisations du trichlorure de bore
Le chlorure de bore est largement utilisé dans la catalyse, la fabrication de semi-conducteurs, la synthèse de matériaux et diverses autres industries en raison de ses propriétés chimiques uniques et de sa polyvalence.
- Le chlorure de bore (BCl3) trouve une application comme catalyseur dans diverses réactions chimiques, notamment en synthèse organique. Il facilite la formation de liaisons carbone-carbone et carbone-hétéroatome dans la production de produits pharmaceutiques, agrochimiques et de chimie fine.
- BCl3 sert de réactif dans la synthèse de polymères à base de bore, tels que le polyborazylène, qui ont des applications dans les revêtements ignifuges et à haute température.
- BCl3 facilite la production de nitrure de bore, un matériau réputé pour sa stabilité thermique et chimique exceptionnelle, largement utilisé dans les applications à haute température et comme lubrifiant.
- L’industrie des semi-conducteurs utilise le BCl3 comme dopant pour incorporer des atomes de bore dans les cristaux de silicium, améliorant ainsi leurs propriétés électriques et les rendant adaptés à une utilisation dans les appareils électroniques.
- En métallurgie, BCl3 agit comme agent fondant pour éliminer les impuretés d’oxyde lors de l’affinage des métaux, améliorant ainsi leur pureté.
- BCl3 joue un rôle central dans la fabrication du carbure de bore, un matériau léger et résistant largement utilisé dans la production de blindages en céramique et d’outils de coupe.
- BCl3 joue un rôle crucial dans la synthèse de nombreux composés contenant du bore, notamment les esters de bore, les acides boroniques et les boranes. Ces composés ont de nombreuses applications dans la recherche chimique et les processus industriels.
- Dans l’industrie pétrolière, le BCl3 sert d’additif pour augmenter l’indice d’octane de l’essence.
Il sert de source de bore dans la production de verre contenant du bore, qui possède des propriétés optiques et thermiques souhaitables.
Des questions:
Q : Quelle est la formule du trichlorure de bore ?
R : La formule du chlorure de bore est BCl3.
Q : Le trichlorure de bore est-il polaire ?
R : Oui, le chlorure de bore est une molécule polaire en raison de la présence d’un doublet libre sur l’atome de bore et de la disposition asymétrique des atomes de chlore.
Q : Qu’est-ce que l’hybridation du bore dans le trichlorure de bore (BCl3) ?
R : L’hybridation du bore dans BCl3 est sp2.
Q : Quelle est la masse d’une molécule de trichlorure de bore ?
R : La masse d’une molécule de chlorure de bore (BCl3) est d’environ 117,17 grammes par mole.
Q : Qu’est-ce que l’hybridation du trichlorure de bore ?
R : L’hybridation du bore dans le chlorure de bore (BCl3) est sp2.
Q : Que se passe-t-il lorsque vous mélangez du trichlorure de bore et de l’hydrogène ?
R : Lorsque le chlorure de bore (BCl3) est mélangé à de l’hydrogène (H2), ils réagissent pour former du bore et du chlorure d’hydrogène gazeux (HCl).
Q : Pourquoi le trichlorure de bore existe-t-il sous forme de monomère alors que le trichlorure d’aluminium existe sous forme de dimère ?
R : La différence de taille et de densité électronique entre les atomes de bore et d’aluminium fait que le chlorure de bore (BCl3) existe en tant que monomère, tandis que le chlorure d’aluminium (AlCl3) forme un dimère en raison de sa capacité à former des liaisons de coordonnées.
Q : Le BCl3 est-il un acide de Lewis ?
R : Oui, BCl3 est un acide de Lewis car il peut accepter une paire d’électrons provenant d’une base de Lewis.
Q : Le BCl3 est-il ionique ou covalent ?
R : BCl3 est un composé covalent.
Q : BCl3 est-il une liaison covalente ?
R : Oui, BCl3 est constitué de liaisons covalentes entre les atomes de bore et de chlore.
Q : Le BCl3 est-il un gaz ?
R : Oui, le BCl3 est un gaz à température et pression standard (STP).
Q : Le BCl3 est-il une molécule polaire ou non polaire ?
R : BCl3 est une molécule polaire en raison de la répartition inégale de la densité électronique causée par la disposition asymétrique des atomes de chlore autour de l’atome de bore.
