Le tribromure de bore (BBr3) est un composé chimique utilisé comme catalyseur dans diverses réactions. Il se compose d’un atome de bore et de trois atomes de brome.
| Nom UICPA | Tribromure de bore |
| Formule moléculaire | BBr3 |
| Numero CAS | 10294-33-4 |
| Synonymes | Tribromoborane ; Bromure de bore ; Bromure de bore (III); Bromobore; Tribromure de bore, [B(Br)3] ; Tribromo-borane |
| InChI | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Propriétés du tribromure de bore
Formule de tribromure de bore
La formule du bromure de bore est BBr3. Il se compose d’un atome de bore et de trois atomes de brome. Ce composé chimique est formé par la combinaison du bore et du brome.
Tribromure De Bore Masse molaire
La masse molaire du bromure de bore (BBr3) peut être calculée en additionnant les masses atomiques du bore et de trois atomes de brome. Le bore a une masse atomique d’environ 10,81 grammes par mole et le brome a une masse atomique d’environ 79,90 grammes par mole. Ainsi, la masse molaire du BBr3 est d’environ 250,60 grammes par mole.
Point d’ébullition du tribromure de bore
Le bromure de bore a un point d’ébullition relativement bas. Il commence à bouillir à environ 91 degrés Celsius (196 degrés Fahrenheit). À cette température, le composé subit un changement de phase d’un liquide à un gaz, libérant des vapeurs de BBr3.
Tribromure de bore Point de fusion
Le point de fusion du bromure de bore est relativement élevé. Il commence à fondre vers -46 degrés Celsius (-51 degrés Fahrenheit). A cette température, le composé solide se transforme à l’état liquide.
Densité du tribromure de bore g/mL
Le bromure de bore a une densité d’environ 2,63 grammes par millilitre (g/mL). Cette densité indique la masse de BBr3 présente dans un millilitre du composé. C’est une mesure de la compacité ou de la concentration de la substance.
Tribromure De Bore Poids moléculaire
Le poids moléculaire du bromure de bore (BBr3) est calculé en additionnant les masses atomiques du bore et de trois atomes de brome. Le poids moléculaire du BBr3 est d’environ 250,60 grammes par mole.
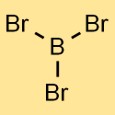
Structure du tribromure de bore
La structure du bromure de bore est constituée d’un atome de bore lié à trois atomes de brome. L’arrangement forme une géométrie planaire trigonale, où l’atome de bore se trouve au centre et les trois atomes de brome sont uniformément répartis autour de lui.
Solubilité du tribromure de bore
Le bromure de bore est un composé très réactif et généralement peu soluble dans l’eau. Il a tendance à réagir avec l’eau pour former de l’acide bromhydrique et de l’acide borique. Cependant, BBr3 est soluble dans les solvants organiques tels que le chloroforme, le tétrachlorure de carbone et le disulfure de carbone.
| Apparence | Liquide incolore |
| Gravité spécifique | 2,63 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 250,60 g/mole |
| Densité | 2,63 g/ml |
| Point de fusion | -46°C |
| Point d’ébullition | 91°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit |
| Solubilité | Soluble dans les solvants organiques tels que le chloroforme, le CCl4 et le disulfure de carbone |
| La pression de vapeur | 78 mmHg |
| Densité de vapeur | 6,52 (air=1) |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du tribromure de bore
Le bromure de bore présente certains risques pour la sécurité et des précautions doivent être prises lors de la manipulation de ce composé. Il est corrosif pour la peau, les yeux et le système respiratoire. Le contact direct peut provoquer des brûlures et de graves irritations. L’inhalation de ses vapeurs peut entraîner une gêne respiratoire. Il réagit vigoureusement avec l’eau en dégageant des fumées toxiques. Par conséquent, il doit être manipulé dans un endroit bien ventilé et un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté. Il doit être conservé à l’abri de l’humidité et des substances incompatibles. En cas d’exposition, des soins médicaux immédiats sont nécessaires. Des protocoles et des directives de sécurité appropriés doivent être suivis pour minimiser les risques associés au bromure de bore.
| Symboles de danger | Corrosif, dangereux lorsqu’il est mouillé |
| Description de la sécurité | Évitez tout contact avec la peau, les yeux et les vêtements. Utiliser dans un endroit bien ventilé. Portez des gants et des lunettes de protection. |
| Numéros d’identification de l’ONU | UN3264 |
| Code SH | 2811.19.9000 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Toxique par inhalation et par ingestion ; provoque de graves brûlures de la peau et des lésions oculaires. |
Méthodes de synthèse du tribromure de bore
Le bromure de bore peut être synthétisé par diverses méthodes. Une méthode courante implique la réaction entre l’oxyde de bore (B2O3) et le brome (Br2). La réaction a lieu en présence d’un catalyseur, tel que le carbone ou l’aluminium, à des températures élevées. La réaction qui en résulte produit du bromure de bore et libère de l’oxygène gazeux.
Une autre méthode implique la réaction entre le trichlorure de bore (BCl3) et le brome. Cette réaction se produit à température ambiante et forme du bromure de bore et du chlore gazeux comme sous-produits.
Pour préparer du bromure de bore, on peut faire réagir le bore avec un excès de brome dans un environnement contrôlé, nécessitant des températures élevées et un contrôle minutieux des conditions de réaction.
Une autre méthode consiste à synthétiser du bromure de bore en faisant réagir des hydrures de bore, tels que le diborane (B2H6) ou le borane (BH3), avec du bromure d’hydrogène (HBr). Cette réaction produit du bromure de bore et de l’hydrogène gazeux comme produits.
Gardez à l’esprit que ces méthodes de synthèse nécessitent des précautions en raison de la nature hautement réactive du bromure de bore. Des protocoles de sécurité appropriés, tels que le port d’un équipement de protection approprié et le travail dans un endroit bien ventilé, doivent être suivis pendant le processus de synthèse.
Utilisations du tribromure de bore
Le bromure de bore (BBr3) a plusieurs utilisations importantes dans diverses industries. Voici quelques applications clés :
- Catalyseur : BBr3 catalyse activement les réactions de synthèse organique, permettant des processus tels que les réactions d’acylation, d’alkylation et d’halogénation.
- Intermédiaires chimiques : BBr3 agit comme précurseur dans la production d’autres composés du bore, synthétisant des réactifs contenant du bore, des acides boroniques et des polymères à base de bore.
- Polymérisation : BBr3 participe activement aux réactions de polymérisation, notamment dans la production de polymères comme le polyéthylène et le polypropylène, servant de catalyseur acide de Lewis.
- Agent dopant : L’industrie des semi-conducteurs utilise activement le BBr3 comme agent dopant, modifiant les propriétés électriques du silicium pour l’adéquation des appareils électroniques.
- Détection de gaz : BBr3 réagit activement avec des gaz spécifiques comme l’ammoniac, ce qui le rend adapté aux détecteurs de gaz et aux capteurs utilisés à des fins de détection et de surveillance.
- Réactif de laboratoire : BBr3 sert activement de réactif dans diverses expériences et recherches en laboratoire, effectuant des réactions de bromation et agissant comme source d’atomes de brome en chimie synthétique.
- Synthèse pharmaceutique : L’industrie pharmaceutique utilise activement BBr3 dans la synthèse de certains médicaments et intermédiaires pharmaceutiques.
Il est important de manipuler le bromure de bore avec précaution, en suivant les protocoles de sécurité appropriés, en raison de sa nature corrosive et réactive.
Des questions:
Q : Quel terme décrit la réactivité du tribromure de bore (BBr3) ?
R : Très réactif.
Q : Quelle est la formule du tribromure de bore ?
R : La formule du bromure de bore est BBr3.
Q : Combien d’atomes de bore y a-t-il dans 3,24 grammes de tribromure de bore ?
R : Il y a 0,053 mole de BBr3 dans 3,24 grammes, ce qui correspond à 0,159 mole de bore, soit environ 9,62 x 10^22 atomes.
Q : Combien de grammes de tribromure de bore peuvent être produits à partir de 3,49 grammes de brome ?
R : La masse molaire du BBr3 est de 250,60 g/mol. Ainsi, environ 3,49 grammes de brome peuvent produire environ 3,34 grammes de bromure de bore.
Q : Quel est le nom du composé de formule BBr3 ?
R : Le composé de formule BBr3 est appelé bromure de bore.
Q : Le tribromure de bore est-il polaire ou non polaire ?
R : Le bromure de bore est un composé polaire.
Q : Quelle est la géométrie électronique du BBr3 ?
R : La géométrie électronique de BBr3 est planaire trigonale.
Q : Quelle est la structure de Lewis pour BBr3 ?
R : Dans la structure de Lewis de BBr3, il y a un atome de bore au centre entouré de trois atomes de brome.
Q : Combien de pics dans BBr3 ?
R : Le bromure de bore (BBr3) présente un pic dans son spectre RMN.
