Le 4-aminobenzoate d’éthyle, également connu sous le nom de benzocaïne, est un anesthésique local couramment utilisé dans les procédures dentaires et les produits topiques pour soulager la douleur. Cela fonctionne en bloquant les signaux nerveux.
| Nom UICPA | 4-aminobenzoate d’éthyle |
| Formule moléculaire | C9H11NO2 |
| Numero CAS | 94-09-7 |
| Synonymes | Benzocaïne, ester éthylique de l’acide p-aminobenzoïque, aminobenzoate d’éthyle, p-aminobenzoate d’éthyle, benzoate de 4-(éthoxycarbonyl)anilinium |
| InChI | InChI=1S/C9H11NO2/c1-2-12-9(11)7-3-5-8(10)6-4-7/h3-6H,2,10H2,1H3 |
4-aminobenzoate d’éthyle masse molaire:
La masse molaire du 4-aminobenzoate d’éthyle est 165,19 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes d’une molécule. La masse molaire est un paramètre important dans les réactions chimiques et est utilisée pour déterminer la quantité de substance présente dans un échantillon.
Point d’ébullition du 4-aminobenzoate d’éthyle :
Le point d’ébullition du 4-aminobenzoate d’éthyle est de 310,7 °C. Le point d’ébullition est la température à laquelle la pression de vapeur d’un liquide est égale à la pression externe. Au point d’ébullition, une substance subit une transition de phase du liquide au gaz. Le point d’ébullition élevé du 4-aminobenzoate d’éthyle en fait un composé approprié pour une utilisation dans les procédures dentaires et médicales impliquant des températures élevées.
Point de fusion du 4-aminobenzoate d’éthyle :
Le point de fusion du 4-aminobenzoate d’éthyle est de 89 à 92 °C. Le point de fusion est la température à laquelle une substance solide passe à l’état liquide. Le point de fusion d’un composé dépend de sa structure chimique, de sa pureté et de sa pression. Le 4-aminobenzoate d’éthyle a un point de fusion bas, ce qui le rend facile à manipuler et à utiliser dans la préparation d’anesthésiques topiques et d’analgésiques.
Densité du 4-aminobenzoate d’éthyle g/ml :
La densité du 4-aminobenzoate d’éthyle est de 1,17 g/mL. La densité est la quantité de masse par unité de volume d’une substance. La densité d’un composé dépend de son poids moléculaire, de sa température et de sa pression. La haute densité du 4-aminobenzoate d’éthyle en fait un composé lourd, qui peut être facilement mesuré et utilisé en quantités précises dans des réactions chimiques.
Poids moléculaire de la benzocaïne :
Le poids moléculaire de la benzocaïne est de 165,19 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire d’un composé est important pour déterminer ses propriétés physiques et chimiques.
Structure de la benzocaïne :
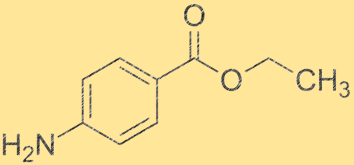
La structure de la benzocaïne est une poudre cristalline blanche de formule chimique C9H11NO2. Il possède un cycle benzénique auquel est attaché un groupe carboxyle et un groupe amino. Le groupe éthyle est attaché au groupe amino, ce qui en fait un dérivé de l’acide benzoïque. La structure de la benzocaïne est importante pour comprendre ses propriétés physiques et chimiques.
Formule de benzocaïne :
La formule chimique de la benzocaïne est C9H11NO2. C’est un dérivé de l’acide benzoïque et possède un groupe éthyle attaché au groupe amino. La formule de la benzocaïne est utilisée pour représenter la composition du composé et est importante pour comprendre ses propriétés physiques et chimiques.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,17 g/ml |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 165,19 g/mole |
| Densité | 1,17 g/ml |
| Point de fusion | 89-92 °C |
| Point d’ébullition | 310,7 °C |
| Point d’éclair | 164,2 °C |
| Solubilité dans l’eau | Légèrement soluble |
| Solubilité | Soluble dans l’éthanol, le chloroforme, l’éther |
| Pression de vapeur | 1,07E-07 mmHg à 25°C |
| Densité de vapeur | 5,7 (contre l’air) |
| pKa | 2.5 |
| pH | 6,5 – 7,5 |
Sécurité et dangers du 4-aminobenzoate d’éthyle
La benzocaïne peut provoquer une irritation de la peau et des yeux au contact. L’ingestion ou l’inhalation du composé peut provoquer une irritation du système digestif ou respiratoire. Une exposition prolongée ou répétée à la benzocaïne peut causer des dommages au foie ou aux reins. Le composé n’est pas considéré comme cancérigène ou mutagène, mais il convient de faire preuve de prudence lors de sa manipulation. Un équipement de protection individuelle approprié doit être porté, tel que des gants et des lunettes de sécurité, lors de la manipulation de la benzocaïne. En cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin. La benzocaïne doit être conservée dans un endroit frais et sec et à l’écart des sources d’ignition ou de chaleur.
| Symboles de danger | XI |
| Description de la sécurité | S22-S24/25-S36-S37 |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 29224990 |
| Classe de danger | Irritant |
| Groupe d’emballage | Non réglementé |
| Toxicité | DL50 (rat, orale) = 940 mg/kg ; DL50 (rat, cutanée) > 2 g/kg |
Méthodes de synthèse du 4-aminobenzoate d’éthyle
La benzocaïne, également connue sous le nom de benzocaïne, peut être synthétisée par diverses méthodes. Une méthode courante implique la réaction de l’acide p-aminobenzoïque avec de l’éthanol en présence d’un catalyseur acide fort, tel que l’acide sulfurique ou l’acide chlorhydrique. L’ester éthylique résultant de l’acide p-aminobenzoïque est ensuite traité avec du nitrite de sodium et de l’acide chlorhydrique pour former le sel de diazonium. Ce sel réagit ensuite avec l’acétate de sodium et l’anhydride acétique pour donner du 4-acétoxy-3-nitrobenzoate d’éthyle, qui est ensuite réduit avec de l’étain et de l’acide chlorhydrique pour produire de la benzocaïne.
Une autre méthode implique la réaction de la p-nitroaniline avec le chloroformiate d’éthyle en présence d’hydroxyde de sodium pour former du p-nitrophénylcarbamate d’éthyle. Ce composé est ensuite réduit avec de l’hydrogène gazeux et un catalyseur au palladium pour donner de la benzocaïne.
Dans une troisième méthode, le 4-nitrobenzoate d’éthyle est réduit avec de la poussière de zinc et de l’acide chlorhydrique pour produire de la benzocaïne.
Quelle que soit la méthode de synthèse utilisée, le composé résultant doit être purifié par recristallisation ou d’autres méthodes pour obtenir un produit pur. La benzocaïne est un anesthésique local couramment utilisé et est également utilisée dans la production de divers produits pharmaceutiques et cosmétiques.
Utilisations du 4-aminobenzoate d’éthyle
La benzocaïne, un anesthésique local courant, engourdit la zone touchée et procure un soulagement temporaire de la douleur et des démangeaisons causées par des irritations cutanées mineures, des maux de gorge, des maux de dents et des poussées dentaires. Il est disponible sous diverses formes, telles que crèmes, gels, sprays et pastilles, et est largement utilisé dans les produits pharmaceutiques et cosmétiques. C’est un ingrédient courant dans les pastilles contre la toux, les sprays pour la gorge, les gels analgésiques oraux, les lotions de protection solaire et les baumes à lèvres pour soulager la douleur causée par les coups de soleil et les lèvres gercées.
L’industrie alimentaire utilise également la benzocaïne comme agent aromatisant dans les bonbons, le chewing-gum et d’autres produits de confiserie pour produire un effet rafraîchissant et engourdissant. La Food and Drug Administration (FDA) des États-Unis approuve son utilisation dans les produits alimentaires.
Cependant, la benzocaïne ne doit être utilisée que selon les directives d’un professionnel de la santé ou spécifiées sur l’étiquette du produit afin d’éviter les effets secondaires indésirables tels qu’une irritation cutanée et des réactions allergiques. Il est donc essentiel de l’utiliser avec prudence.
Des questions:
Le 4-aminobenzoate d’éthyle est-il polaire ?
Oui, le 4-aminobenzoate d’éthyle est polaire. Il possède un groupe fonctionnel polaire (le groupe amino) et un groupe ester polaire, ce qui lui confère un moment dipolaire net. Cela signifie qu’elle a une charge partielle positive à une extrémité de la molécule et une charge partielle négative à l’autre extrémité, ce qui la rend polaire. Cette propriété de la benzocaïne la rend soluble dans les solvants polaires, comme l’eau et l’éthanol, et moins soluble dans les solvants non polaires, comme l’hexane et le benzène. La polarité du 4-aminobenzoate d’éthyle affecte également ses propriétés physiques et chimiques, telles que son point de fusion, son point d’ébullition et sa solubilité.
Le 4-aminobenzoate d’éthyle est-il soluble dans l’eau ?
Oui, le 4-aminobenzoate d’éthyle est partiellement soluble dans l’eau. Il possède un groupe fonctionnel polaire et un groupe ester, ce qui le rend capable de former des liaisons hydrogène avec les molécules d’eau. Cependant, sa solubilité dans l’eau est limitée en raison du groupe éthyle non polaire présent dans sa structure. Cela signifie que le 4-aminobenzoate d’éthyle est plus soluble dans les solvants organiques, tels que l’éthanol et l’acétone, que dans l’eau. La solubilité du 4-aminobenzoate d’éthyle dans l’eau dépend également de divers facteurs, tels que la température, le pH et la présence d’autres substances. Dans des conditions normales, la solubilité du 4-aminobenzoate d’éthyle dans l’eau est d’environ 0,3 g/L à 25°C.
