Le 2-butène (CH3CHCHCH3) est un gaz incolore utilisé dans la production de divers produits chimiques. Il est inflammable et dégage une légère odeur. Le 2-butène est couramment utilisé dans la fabrication de caoutchouc synthétique et d’autres polymères.
| Nom de l’UICPA | Mais-2-ène |
| Formule moléculaire | C4H8 ou CH3CHCHCH3 |
| Numero CAS | 624-64-6 |
| Synonymes | 2-Butène, Butylène, Éthyléthylène, But-2-ène, B-Butène, Butène-2 |
| InChI | InChI=1S/C4H8/c1-3-4-2/h3-4H,1-2H3 |
Propriétés du 2-butène
Formule 2-Butène
La formule chimique du 2-Butène est C4H8. Cela signifie que la molécule contient quatre atomes de carbone et huit atomes d’hydrogène. La formule donne des informations sur les types et le nombre d’atomes présents dans la molécule, mais elle ne fournit pas d’informations sur sa structure ou ses propriétés.
2-Butène Masse molaire
Le but-2-ène a une masse molaire de 56,11 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes de la molécule. Pour le but-2-ène, il y a quatre atomes de carbone et huit atomes d’hydrogène, ce qui donne un total de 56,11 g/mol.
Point d’ébullition du 2-butène
Le point d’ébullition du but-2-ène est de 0,88 °C. Le point d’ébullition est la température à laquelle un liquide se transforme en gaz. Dans le cas du but-2-ène, c’est un gaz incolore à température ambiante, mais il peut être condensé en liquide en abaissant la température. À 0,88 °C, le but-2-ène commencera à bouillir et se transformera en gaz.
2-Butène Point de fusion
Le but-2-ène n’a pas de point de fusion distinct car il existe sous forme de gaz à température ambiante. Cependant, s’il est refroidi à une température suffisamment basse, il peut se condenser en un liquide. A ce stade, la température à laquelle il se solidifie dépendra des conditions de l’expérience.
Densité du 2-butène g/mL
La densité du but-2-ène est de 0,614 g/mL à température et pression ambiantes. La densité est la quantité de masse par unité de volume. Dans le cas du but-2-ène, cela signifie que pour chaque millilitre de but-2-ène, il y a 0,614 gramme de masse.
2-Butène Poids moléculaire
Le poids moléculaire du but-2-ène est de 56,11 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Dans le cas du but-2-ène, il y a quatre atomes de carbone et huit atomes d’hydrogène, ce qui donne un total de 56,11 g/mol.
Structure 2-butène
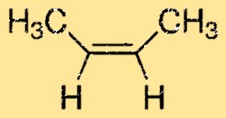
Le but-2-ène a une structure linéaire et appartient au groupe des alcènes. Il possède deux doubles liaisons carbone-carbone, qui lui confèrent sa réactivité caractéristique. La molécule possède un atome de carbone central auquel sont attachés deux groupes méthyle et deux atomes d’hydrogène attachés à chacun des carbones aux extrémités de la molécule.
| Apparence | Gaz incolore |
| Densité spécifique | 0,614 à 25°C |
| Couleur | Incolore |
| Odeur | Bénin |
| Masse molaire | 56,11 g/mole |
| Densité | 0,614 g/mL à 25°C |
| Point de fusion | -139,8°C |
| Point d’ébullition | 0,88 °C |
| Point d’éclair | -19°C |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 276,8 kPa à 25°C |
| Densité de vapeur | 2,5 (air = 1) |
| pKa | 44 |
| pH | N’est pas applicable |
Sécurité et dangers du 2-butène
Le but-2-ène peut présenter plusieurs risques pour la sécurité s’il n’est pas manipulé correctement. Il est hautement inflammable et peut s’enflammer facilement lorsqu’il est exposé à la chaleur, aux flammes ou aux étincelles. C’est également un irritant respiratoire et oculaire et peut provoquer des étourdissements, des maux de tête et des nausées lorsqu’il est inhalé. De plus, il est nocif en cas d’ingestion et peut endommager les organes internes. Des mesures de sécurité appropriées telles que l’utilisation d’un équipement de protection et une bonne ventilation doivent être suivies lors de la manipulation du but-2-ène. Il est important d’avoir une formation appropriée et une connaissance de ses dangers potentiels avant de manipuler le produit chimique.
| Symboles de danger | Inflammable |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Utiliser un équipement électrique/de ventilation/d’éclairage antidéflagrant. Utilisez uniquement des outils anti-étincelles. Prenez des mesures de précaution contre les décharges statiques. Gardez le récipient bien fermé. Conserver dans un endroit bien ventilé. |
| Numéros d’identification de l’ONU | UN1012 |
| Code SH | 290110 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Nocif en cas d’ingestion, irritant pour les voies respiratoires et les yeux. |
Méthodes de synthèse du 2-butène
Diverses méthodes peuvent synthétiser le but-2-ène, notamment le craquage des hydrocarbures, la déshydratation du 2-butanol et la déshydrogénation catalytique des butanes.
La méthode de craquage consiste à chauffer des hydrocarbures tels que le naphta, le gazole ou le kérosène à des températures élevées, ce qui les amène à se décomposer en molécules plus petites, notamment le but-2-ène. On peut réaliser le procédé par craquage thermique ou catalytique.
Pour produire du but-2-ène, les gens utilisent la déshydratation du 2-butanol comme autre méthode. Dans cette méthode, ils chauffent le 2-butanol avec un agent déshydratant, tel que l’acide sulfurique ou l’acide phosphorique , pour créer du but-2-ène et de l’eau. La réaction est réversible et ils peuvent éliminer l’eau du mélange réactionnel pour pousser la réaction vers la formation de but-2-ène.
Une autre méthode utilisée pour synthétiser le but-2-ène est la déshydrogénation catalytique des butanes. Ce processus consiste à chauffer du butane sur un catalyseur tel que l’alumine chromée ou le platine pour produire du but-2-ène et de l’hydrogène. La réaction présente une exothermicité élevée et les chimistes peuvent la réaliser dans un réacteur à lit fixe ou à lit fluidisé.
Utilisations du 2-butène
Le but-2-ène a un large éventail d’applications industrielles et commerciales en raison de ses propriétés chimiques uniques. Voici quelques utilisations courantes du but-2-ène :
- Production de butadiène : C’est un précurseur du butadiène, un produit chimique utilisé dans la production de caoutchouc synthétique et d’autres élastomères.
- Fabrication de plastiques : utilisé dans la production de plastiques en polyéthylène haute densité (HDPE) et en polyéthylène linéaire basse densité (LLDPE).
- Additif de carburant : utilisé comme additif de carburant pour augmenter l’indice d’octane de l’essence.
- Solvant : Utilisé comme solvant dans diverses industries telles que les peintures, les revêtements et les adhésifs.
- Intermédiaire chimique : utilisé comme intermédiaire dans la production de divers produits chimiques tels que le butanol, le butyraldéhyde et l’acide butyrique.
- Réfrigérant : Utilisé comme réfrigérant dans certaines applications en raison de son faible point d’ébullition et de ses bonnes propriétés de transfert de chaleur.
- Recherche et développement : également utilisé en recherche et développement pour étudier la cinétique de réaction et la thermodynamique de diverses réactions chimiques.
Des questions:
Q : Qu’est-ce qui décrit le mieux la structure du 2-butène ?
R : le but-2-ène est un hydrocarbure insaturé avec une chaîne à quatre carbones et une double liaison entre le deuxième et le troisième atome de carbone.
Q : Quelle est l’hybridation au niveau des deux atomes de carbone centraux du 2-butène ?
R : Les deux atomes de carbone centraux du but-2-ène sont hybridés sp², ce qui signifie qu’ils ont chacun trois orbitales hybrides et une orbitale p non hybridée.
Q : Quels réactifs peuvent être utilisés pour convertir le cis-2-butène en trans-2-butène ?
R : Des réactifs tels que le brome ou l’hydrogène gazeux peuvent être utilisés pour convertir le cis-but-2-ène en trans-but-2-ène grâce à un processus appelé isomérisation cis-trans.
Q : Pourquoi pourrait-il être difficile de visualiser la séparation du cis- et du trans-2-butène par CCM ?
R : Il peut être difficile de visualiser la séparation du cis- et du trans-but-2-ène par chromatographie sur couche mince (CCM) car les deux isomères ont des propriétés physiques très similaires, telles que la polarité et le point d’ébullition, ce qui rend difficile la différenciez-les en utilisant TLC.
Q : Combien de stéréoisomères uniques résultent de la réaction impliquant le trans-but-2-ène ?
R : La réaction impliquant le trans-but-2-ène donne naissance à deux stéréoisomères uniques, car il n’y a que deux configurations possibles de substituants autour de la double liaison : trans et cis.
