Le 2-Butanol est un liquide incolore et inflammable avec une odeur sucrée. Il est couramment utilisé comme solvant et dans la production de produits chimiques tels que la méthyléthylcétone et l’acétate de butyle.
| Nom UICPA | 2-Butanol |
| Formule moléculaire | C4H10O |
| Numero CAS | 78-92-2 |
| Synonymes | Alcool sec-butylique, alcool 2-butylique, butan-2-ol, éthylméthylcarbinol |
| InChI | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
Propriétés du 2-butanol
Formule 2-butanol
La formule chimique du 2-Butanol est C4H10O, ce qui indique qu’il contient quatre atomes de carbone, dix atomes d’hydrogène et un atome d’oxygène. C’est un isomère du butanol et a une formule développée de CH3CH(OH)CH2CH3. Le « 2 » dans le nom du composé signifie la position du groupe hydroxyle sur la chaîne carbonée.
2-Butanol Masse molaire
La masse molaire de C4H10O est de 74,12 g/mol. Cette valeur peut être obtenue en additionnant les masses atomiques de tous les atomes du composé, qui sont de 12,01 g/mol pour le carbone, 1,01 g/mol pour l’hydrogène et 16,00 g/mol pour l’oxygène. La masse molaire est une propriété importante du C4H10O car elle est utilisée pour calculer la quantité de composé requise dans les réactions chimiques.
Point d’ébullition du 2-butanol
Le point d’ébullition du C4H10O est de 99,5 °C (211,1 °F) à pression standard (1 atm). C’est la température à laquelle l’état liquide du composé passe à l’état gazeux. Le point d’ébullition du C4H10O est supérieur à celui du butane (−0,5 °C) et du butène (−6,3 °C) en raison de sa liaison hydrogène et de son poids moléculaire.
2-Butanol Point de fusion
Le point de fusion du C4H10O est de −114,7 °C (−174,5 °F). C’est la température à laquelle l’état solide du composé passe à l’état liquide. Le point de fusion du C4H10O est inférieur à celui du butane (−138,4 °C) et du butène (−185,3 °C) en raison de sa structure ramifiée et de ses liaisons hydrogène.
2-Butanol Densité g/mL
La densité du C4H10O est de 0,809 g/mL à 25 °C (77 °F). Cette valeur indique la masse du composé par unité de volume de la substance. La densité du C4H10O est supérieure à celle du butane (0,588 g/mL) et du butène (0,587 g/mL) en raison de son poids moléculaire et de ses forces intermoléculaires.
2-Butanol Poids moléculaire
Le poids moléculaire du C4H10O est de 74,12 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule du composé. Le poids moléculaire est utilisé pour calculer d’autres propriétés du composé, telles que la masse molaire, le point d’ébullition et la densité.
Structure du 2-butanol
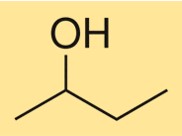
La structure du C4H10O est caractérisée par une chaîne carbonée ramifiée avec un groupe hydroxyle attaché au deuxième atome de carbone. C’est un alcool primaire avec un centre chiral, ce qui signifie qu’il existe sous forme de deux stéréoisomères, (R)-C4H10O et (S)-C4H10O. Le composé a une structure tridimensionnelle en raison de la disposition tétraédrique des atomes de carbone et d’oxygène autour du groupe hydroxyle.
Solubilité du 2-butanol
C4H10O est un composé polaire et est partiellement soluble dans l’eau. La solubilité du C4H10O dans l’eau est de 80 g/L à 25 °C (77 °F). Le composé est plus soluble dans les solvants organiques tels que l’éthanol, l’éther et l’acétone. La solubilité du C4H10O est influencée par des facteurs tels que la température, la pression et la nature du solvant.
| Apparence | Liquide transparent |
| Gravité spécifique | 0,810 g/mL à 25 °C (77 °F) |
| Couleur | Incolore |
| Odeur | Caractéristique |
| Masse molaire | 74,12 g/mole |
| Densité | 0,809 g/mL à 25 °C (77 °F) |
| Point de fusion | −114,7 °C (−174,5 °F) |
| Point d’ébullition | 99,5 °C (211,1 °F) à une pression de 1 atm |
| Point d’éclair | 39 °C (102 °F) tasse fermée |
| Solubilité dans l’eau | 80 g/L à 25 °C (77 °F) |
| Solubilité | Soluble dans l’éthanol, l’éther et l’acétone |
| Pression de vapeur | 8,7 mmHg à 25 °C (77 °F) |
| Densité de vapeur | 2,6 (air = 1) |
| pKa | 16 |
| pH | 7,0-8,5 |
Sécurité et dangers du 2-Butanol
Le C4H10O est considéré comme un produit chimique relativement sûr lorsqu’il est manipulé correctement. Cependant, l’exposition à des concentrations élevées peut provoquer une irritation des yeux, de la peau et des voies respiratoires. Cela peut également provoquer des maux de tête, des étourdissements et des nausées. L’ingestion de C4H10O peut provoquer une irritation gastro-intestinale et une éventuelle dépression du système nerveux central. De plus, le C4H10O est inflammable et peut présenter un risque d’incendie. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des sources d’ignition. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lors de la manipulation de ce produit chimique. Les déversements doivent être nettoyés rapidement en utilisant des procédures appropriées.
| Symboles de danger | F, Xi |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. EN CAS DE CONTACT AVEC LA PEAU (ou les cheveux) : Enlever immédiatement tous les vêtements contaminés. Rincer la peau à l’eau/douche. EN CAS D’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer. EN CAS D’INGESTION : Rincer la bouche. NE PAS faire vomir. Appelez un CENTRE ANTIPOISON ou un médecin si vous ne vous sentez pas bien. |
| Numéros d’identification de l’ONU | UN1120 |
| Code SH | 2905.13.00 |
| Classe de danger | 3 – Liquides inflammables |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) : 4,6 g/kg ; CL50 (inhalation, rat) : 2 100 ppm/4 h |
Méthodes de synthèse du 2-butanol
Plusieurs méthodes permettent de synthétiser le C4H10O.
Une méthode implique la réduction de l’acétone à l’aide de borohydrure de sodium en présence d’un catalyseur au nickel ou au palladium. La réaction produit un mélange de C4H10O et de son isomère, l’isobutanol, qui peut être séparé par distillation fractionnée.
Une autre méthode implique l’hydratation du 1-butène en utilisant de l’acide sulfurique comme catalyseur. La réaction forme un mélange de C4H10O et de ses isomères, mais le C4H10O souhaité peut être séparé par distillation fractionnée.
Le processus de chimie Reppe consiste à utiliser un catalyseur au palladium ou au nickel pour faire réagir l’acétylène avec le formaldéhyde et l’eau, entraînant la formation d’alcool vinylique. Cette réaction conduit en outre à la synthèse de C4H10O. L’alcool vinylique subit ensuite une hydrogénation pour former C4H10O.
Une autre méthode de synthèse du C4H10O implique l’hydrogénation du crotonaldéhyde en présence d’un catalyseur au nickel. La réaction produit un mélange de C4H10O et de son isomère, mais le C4H10O souhaité peut être isolé par distillation fractionnée.
Utilisations du 2-butanol
Le C4H10O a une variété d’applications dans différentes industries. Certaines de ses utilisations sont :
- Solvant : Utilisé comme solvant dans la fabrication de résines, de vernis et de revêtements. Également utilisé comme solvant pour les éthers et esters de cellulose.
- Carburant : utilisé comme additif pour biocarburant en raison de sa faible toxicité et de sa teneur élevée en énergie. Il s’est avéré avoir un rendement de combustion plus élevé que l’éthanol et est étudié comme alternative potentielle à l’essence.
- Intermédiaire chimique : utilisé comme matière première pour la production d’autres produits chimiques tels que la méthyléthylcétone, la méthylisobutylcétone et le diisobutylène.
- Parfum et parfum : utilisé comme parfum et agent aromatisant dans la production de parfums, de savons et d’autres produits de soins personnels.
- Réactif de laboratoire : utilisé comme solvant et réactif dans les expériences de chimie organique.
- Agent nettoyant : Utilisé comme agent nettoyant dans les produits de nettoyage industriels et ménagers.
- Encre d’imprimerie : Également utilisée comme solvant dans la production d’encres d’imprimerie.
Des questions:
Q : Quel composé carbonylé et quel réactif de Grignard pourraient être utilisés pour préparer du 2-butanol ?
R : Le composé carbonylé qui pourrait être utilisé pour préparer le C4H10O est le butanal (également connu sous le nom de n-butyraldéhyde) et le réactif de Grignard qui pourrait être utilisé est le bromure d’éthyle magnésium. La réaction entre le butanal et le bromure d’éthylmagnésium produit du C4H10O comme produit final.
Q : Le 2-butanol est-il polaire ?
R : Oui, C4H10O est polaire. Il contient un groupe hydroxyle (-OH), qui est un groupe fonctionnel polaire qui rend la molécule polaire.
Q : Le 2-butanol est-il soluble dans l’eau ?
R : Oui, le C4H10O est partiellement soluble dans l’eau. Le groupe hydroxyle polaire du C4H10O lui permet de former des liaisons hydrogène avec les molécules d’eau, ce qui le rend quelque peu soluble dans l’eau.
Q : Le 2-butanol a-t-il une liaison hydrogène ?
R : Oui, C4H10O peut former des liaisons hydrogène. Le groupe hydroxyle (-OH) dans C4H10O peut former des liaisons hydrogène avec d’autres molécules polaires contenant des sites de liaison hydrogène, comme l’eau.
