Le 1-pentanol est un alcool liquide incolore comportant cinq atomes de carbone. Il est utilisé comme solvant et intermédiaire dans la synthèse chimique et a diverses applications industrielles.
| Nom UICPA | Pentane-1-ol |
| Formule moléculaire | C₅H₁₁OH |
| Numero CAS | 71-41-0 |
| Synonymes | Alcool amylique, alcool n-amylique, 1-hydroxypentane, alcool n-pentylique, pentanol, alcool pentylique |
| InChI | InChI=1S/C5H12O/c1-2-3-4-5-6/h6H,2-5H2,1H3 |
Propriétés du 1-pentanol
Formule 1-pentanol
La formule du pentanol est C₅H₁₁OH. Il se compose de cinq atomes de carbone, de onze atomes d’hydrogène et d’un groupe hydroxyle (-OH). La formule représente la disposition spécifique et les types d’atomes dans une molécule de pentanol.
1-Pentanol Masse molaire
La masse molaire du pentanol est calculée en additionnant les masses atomiques de ses atomes constitutifs. La masse molaire du pentanol est d’environ 88,15 grammes par mole (g/mol). Il fournit des informations sur la masse d’une mole de molécules de pentanol.
Point d’ébullition du 1-pentanol
Le pentanol a un point d’ébullition d’environ 138 degrés Celsius (280 degrés Fahrenheit). A cette température, le pentanol liquide se transforme en état gazeux. Le point d’ébullition indique la température à laquelle une substance change de phase liquide à gazeuse.
1-Pentanol Point de fusion
Le point de fusion du pentanol est d’environ -79 degrés Celsius (-110 degrés Fahrenheit). C’est la température à laquelle le pentanol solide se transforme en sa forme liquide. Le point de fusion représente le passage de l’état solide à l’état liquide.
Densité du 1-pentanol g/mL
La densité du pentanol est d’environ 0,81 gramme par millilitre (g/mL). La densité est la mesure de la masse par unité de volume. Cela indique à quel point les molécules d’une substance sont serrées.
1-Pentanol Poids moléculaire
Le poids moléculaire du 1-pentanol est d’environ 88,15 grammes par mole (g/mol). C’est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire est utilisé dans divers calculs, tels que la détermination du nombre de moles ou de la masse d’une substance.
Structure du 1-pentanol
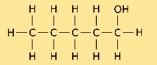
La structure du pentanol consiste en une chaîne linéaire de cinq atomes de carbone, avec un groupe hydroxyle (-OH) attaché à une extrémité. Il a la formule chimique CH₃(CH₂)₃CH₂OH. La structure du pentanol joue un rôle crucial dans la détermination de ses propriétés physiques et chimiques.
Solubilité du 1-pentanol
Le pentanol est soluble dans les solvants organiques, tels que l’éther et l’acétone, mais sa solubilité dans l’eau est limitée. Il forme des liaisons hydrogène avec les molécules d’eau en raison de la présence du groupe hydroxyle. La solubilité du pentanol influence son comportement dans différents environnements.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,809-0,814 g/mL |
| Couleur | Incolore |
| Odeur | Odeur caractéristique |
| Masse molaire | 88,15 g/mole |
| Densité | 0,81 g/ml |
| Point de fusion | -79°C (-110°F) |
| Point d’ébullition | 138°C (280°F) |
| Point d’éclair | 54°C (129°F) |
| Solubilité dans l’eau | Légèrement soluble |
| Solubilité | Soluble dans les solvants organiques tels que l’éther et l’acétone |
| Pression de vapeur | 2,5 mmHg (25 °C) |
| Densité de vapeur | 3,0 (air = 1) |
| pKa | 16.2 |
| pH | 6,5-8,5 |
1-Pentanol Sécurité et dangers
Le pentanol pose certaines considérations de sécurité et de danger. Il doit être manipulé avec prudence en raison de sa nature inflammable, avec un point d’éclair de 54°c (129°f). Évitez tout contact avec des flammes nues ou des sources d’inflammation. L’inhalation des vapeurs de pentanol peut provoquer une irritation du système respiratoire. Le contact direct avec la peau peut entraîner une irritation ou un dessèchement de la peau. En cas d’ingestion accidentelle, il peut provoquer une gêne gastro-intestinale. Une ventilation adéquate doit être maintenue lorsque vous travaillez avec du pentanol afin de minimiser l’exposition aux vapeurs. Des équipements de protection individuelle, tels que des gants et des lunettes de sécurité, doivent être utilisés pour garantir une manipulation sûre. Il est important de consulter la fiche de données de sécurité et de suivre les protocoles de sécurité appropriés lorsque vous travaillez avec du pentanol.
| Symboles de danger | Inflammable (F) |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Utiliser un équipement électrique/de ventilation/d’éclairage antidéflagrant. Évitez de respirer les vapeurs. Porter des gants de protection/un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | ONU 1105 |
| Code SH | 2905.16.00 |
| Classe de danger | Classe 3 (Liquides inflammables) |
| Groupe d’emballage | GE II |
| Toxicité | Peut provoquer une irritation. |
Méthodes de synthèse du 1-pentanol
Diverses méthodes permettent la synthèse du pentanol.
Une méthode courante est l’hydroformylation du 1-butène , qui implique la réaction du 1-butène avec du monoxyde de carbone et de l’hydrogène en présence d’un catalyseur au rhodium. Ce processus conduit à la formation d’un mélange d’intermédiaires aldéhydiques, suivi d’une hydrogénation pour produire du pentanol.
Une autre méthode implique la réduction du pentanal, un composé aldéhyde, à l’aide d’un agent réducteur tel que le borohydrure de sodium . Cette réaction de réduction convertit le pentanal en pentanol.
Les chimistes peuvent procéder à l’hydratation du 1-pentène, un alcène, pour produire du pentanol. Cette réaction implique l’ajout d’eau à travers la double liaison carbone-carbone du 1-pentène, entraînant la formation de pentanol.
De plus, on peut synthétiser le pentanol en hydrogénant l’acide pentanoïque, un acide carboxylique. La réaction a lieu en présence d’un catalyseur approprié, tel que du palladium sur charbon et de l’hydrogène gazeux, conduisant à la conversion de l’acide pentanoïque en pentanol.
Ces méthodes de synthèse offrent différentes voies pour obtenir du pentanol, offrant une flexibilité de production en fonction des matières premières disponibles et des conditions de réaction souhaitées.
Utilisations du 1-pentanol
Le pentanol a diverses utilisations dans différentes industries en raison de ses propriétés et de sa polyvalence. Voici quelques-unes de ses applications notables :
- Solvant : Le pentanol sert de solvant dans des industries telles que les produits pharmaceutiques, les revêtements et les cosmétiques, dissolvant efficacement de nombreux composés organiques. Il joue un rôle crucial dans la formulation des peintures, vernis et produits de soins personnels.
- Synthèse chimique : Il sert d’intermédiaire important dans la synthèse de divers produits chimiques. Il peut subir des réactions pour produire des esters, des éthers et d’autres dérivés, qui trouvent des applications dans la production de parfums, d’arômes et d’ingrédients pharmaceutiques.
- Extraction : Dans les processus d’extraction, le pentanol est utilisé pour séparer certains composés des produits naturels. Il aide à extraire des substances précieuses des matières végétales, contribuant ainsi à la production d’huiles essentielles, de parfums et d’arômes.
- Agent de nettoyage : des industries telles que l’électronique, l’optique et la fabrication de précision utilisent le pentanol comme agent de nettoyage en raison de sa capacité à dissoudre les huiles, les graisses et autres contaminants. Il assure un nettoyage en profondeur en éliminant les résidus des surfaces.
- Additif de carburant : Dans certains cas, le pentanol sert d’additif de carburant pour améliorer l’efficacité de la combustion et réduire les émissions. Il améliore les performances et l’impact environnemental des carburants lorsqu’ils sont mélangés à de l’essence ou à d’autres carburants.
- Applications industrielles : Le pentanol est utilisé dans divers processus industriels, notamment le décapage de peinture, le dégraissage des métaux et le nettoyage industriel. Ses propriétés le rendent efficace pour éliminer les revêtements et les contaminants des surfaces.
- Recherche et laboratoire : Le pentanol sert de réactif ou de solvant dans la recherche scientifique et en laboratoire. Il facilite les réactions, les extractions et les purifications dans diverses procédures expérimentales.
Les diverses applications du Pentanol mettent en évidence son importance dans plusieurs industries, où ses propriétés uniques contribuent au développement de nombreux produits et procédés.
Des questions:
Q : Lequel des éléments suivants est le plus soluble dans l’eau : l’acide acétique, le pentanol, l’acide butanoïque ou le pentanal ?
R : L’acide acétique est le plus soluble dans l’eau parmi les composés donnés.
Q : Le pentanol est-il soluble dans l’eau ?
R : Le pentanol a une solubilité limitée dans l’eau.
Q : Quelle est la fonction du catalyseur acide pour favoriser la déshydratation du 4-méthyl-2-pentanol ?
R : Le catalyseur acide facilite l’élimination d’une molécule d’eau du 4-méthyl-2-pentanol, favorisant sa déshydratation.
Q : Quel produit est obtenu de la réaction de l’acide sulfurique, de l’acide acétique et du 1-pentanol ?
R : La réaction entre l’acide sulfurique, l’acide acétique et le pentanol entraîne la formation de composés esters.
Q : Le pentanol a-t-il une liaison hydrogène ?
R : Oui, le pentanol peut présenter une liaison hydrogène en raison de la présence du groupe hydroxyle.
Q : Comment préparer de l’acide pentanoïque à partir du 1-pentanol ?
R : L’acide pentanoïque peut être obtenu en oxydant le 1-pentanol à l’aide d’agents oxydants appropriés ou en hydrolysant son ester correspondant.
Q : Quel produit organique obtiendriez-vous de la réaction du 1-pentanol avec CrO3, H2O et H2SO4 ?
R : La réaction du 1-pentanol avec CrO3, H2O et H2SO4 donne lieu à la formation de l’acide carboxylique correspondant.
Q : Qu’est-ce qui est le moins soluble dans l’eau, le 1-pentanol ou le 1-heptanol ? Expliquer.
R : le pentanol est moins soluble dans l’eau que le 1-heptanol en raison de sa chaîne hydrocarbonée plus courte, ce qui entraîne des interactions plus faibles avec les molécules d’eau.
Q : Quel produit organique obtiendriez-vous de la réaction du 1-pentanol avec le PBr3 ?
R : La réaction du pentanol avec PBr3 conduit à la substitution du groupe hydroxyle, entraînant la formation de 1-bromopentane.
