Le 1-Butène (C4H8) est un gaz incolore avec une légère odeur sucrée. Il est utilisé dans la production de polyéthylène et comme matière première pour d’autres produits chimiques.
| Nom UICPA | Mais-1-ène |
| Formule moléculaire | C4H8 |
| Numero CAS | 106-98-9 |
| Synonymes | Butylène, Éthylène, Vinylméthylène |
| InChI | 1S/C4H8/c1-3-4-2/h3-4H,1-2H3 |
Propriétés du 1-butène
Formule 1-Butène
La formule chimique du 1-Butène est C4H8, qui représente le nombre et les types d’atomes présents dans la molécule. La formule indique que le 1-Butène contient quatre atomes de carbone et huit atomes d’hydrogène. La formule du 1-Butène est utile pour déterminer son poids moléculaire et calculer sa réactivité dans les réactions chimiques.
1-Butène Masse molaire
Le 1-Butène, également connu sous le nom de But-1-ène, a une masse molaire de 56,11 g/mol. La masse molaire fait référence à la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de chaque atome d’une molécule. Dans le cas du but-1-ène, la molécule contient quatre atomes de carbone et huit atomes d’hydrogène, chacun avec sa masse atomique respective.
Point d’ébullition du 1-butène
Le but-1-ène a un point d’ébullition de -6,3 °C ou 20,7 °F. Le point d’ébullition fait référence à la température à laquelle un liquide se transforme en gaz à une pression fixe. Le but-1-ène étant un gaz à température ambiante, il nécessite un point d’ébullition bas pour maintenir son état gazeux. Le point d’ébullition du but-1-ène est affecté par des facteurs tels que la pression et la présence d’autres produits chimiques.
1-Butène Point de fusion
Le but-1-ène a un point de fusion de -185,4 °C ou -301,7 °F. Le point de fusion fait référence à la température à laquelle un solide se transforme en liquide à une pression fixe. Le but-1-ène étant un gaz à température ambiante, il n’existe pas à l’état solide. Cependant, le point de fusion du but-1-ène reste un paramètre utile pour déterminer ses propriétés physiques et chimiques.
Densité du 1-Butène g/mL
Le but-1-ène a une densité de 0,573 g/mL à température ambiante. La densité fait référence à la quantité de masse par unité de volume d’une substance. La densité du but-1-ène est inférieure à celle de l’eau, qui a une densité de 1 g/mL, ce qui indique que le but-1-ène est moins dense que l’eau. La densité du but-1-ène est affectée par des facteurs tels que la température et la pression.
1-Butène Poids moléculaire
Le but-1-ène a un poids moléculaire de 56,11 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire du but-1-ène est un facteur important pour déterminer ses propriétés physiques et chimiques, ainsi que son comportement dans les réactions chimiques.
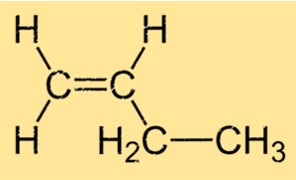
Structure 1-butène
Le but-1-ène a une structure linéaire, avec quatre atomes de carbone liés les uns aux autres dans une chaîne droite et chaque atome de carbone lié à deux atomes d’hydrogène. La formule moléculaire du but-1-ène est C4H8 et appartient au groupe d’hydrocarbures appelés alcènes. La double liaison entre le premier et le deuxième atomes de carbone de la molécule est responsable de sa réactivité dans les réactions chimiques.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,573 |
| Couleur | Incolore |
| Odeur | Légère odeur sucrée |
| Masse molaire | 56,11 g/mole |
| Densité | 0,573 g/mL à température ambiante |
| Point de fusion | -185,4 °C ou -301,7 °F |
| Point d’ébullition | -6,3 °C ou 20,7 °F |
| Point d’éclair | -70 °C (-94 °F) |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 278,4 kPa à 20°C |
| Densité de vapeur | 2,98 (air = 1) |
| pKa | 45.1 |
| pH | Neutre |
Sécurité et dangers du 1-Butène
Le but-1-ène est un gaz inflammable et peut former des mélanges explosifs avec l’air. C’est également un irritant pour les yeux, la peau et le système respiratoire. L’exposition à des concentrations élevées de but-1-ène peut provoquer des étourdissements, des nausées et des maux de tête. Par conséquent, une ventilation appropriée et un équipement de protection doivent être utilisés lors de la manipulation du but-1-ène. Il est important de stocker et de manipuler le but-1-ène à l’écart des sources d’inflammation et des matières incompatibles. En cas de fuite ou de déversement, la zone doit être immédiatement évacuée et les procédures d’intervention d’urgence doivent être suivies. De plus, des méthodes d’élimination appropriées doivent être utilisées pour éviter la contamination de l’environnement.
| Symboles de danger | F+ (hautement inflammable) |
| Description de la sécurité | Tenir à l’écart des sources d’ignition. Utiliser uniquement dans des zones bien ventilées. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | ONU 1012 |
| Code SH | 290110 |
| Classe de danger | 2.1 (Gaz inflammable) |
| Groupe d’emballage | Groupe II |
| Toxicité | L’inhalation de concentrations élevées peut provoquer une dépression du système nerveux central. |
Méthodes de synthèse du 1-butène
Diverses méthodes peuvent synthétiser le but-1-ène, notamment le craquage catalytique des fractions de pétrole brut ou la déshydratation du butanol.
Une méthode courante est la déshydrogénation catalytique des butènes, qui implique l’élimination des atomes d’hydrogène des butènes pour former du butène-1. Différents catalyseurs, tels que la chrome-alumine, la chromite de cuivre ou le platine, peuvent réaliser ce procédé.
Une autre méthode implique la dimérisation sélective de l’éthylène, suivie de la déshydratation des butènes résultants pour former du but-1-ène. Les catalyseurs zéolitiques, tels que le ZSM-5 ou le SAPO-11, peuvent mettre en œuvre ce procédé.
Un complexe de tungstène-carbène peut catalyser la réaction de métathèse entre le propylène et l’éthylène pour produire du but-1-ène. Cette méthode est intéressante car elle permet de produire du but-1-ène à partir de ressources renouvelables, telles que l’éthylène d’origine biologique.
Utilisations du 1-butène
Le but-1-ène est un composé chimique polyvalent qui trouve un large éventail d’applications industrielles et commerciales. Certaines utilisations courantes du but-1-ène comprennent :
- Production de polyéthylène : utilisé comme co-monomère dans la production de polyéthylène haute densité et linéaire basse densité. L’ajout de 1-Butène contribue à améliorer les propriétés mécaniques et thermiques du polymère.
- Intermédiaires chimiques : utilisés comme intermédiaire chimique dans la production de divers produits chimiques, tels que le butadiène, les butènes, le butyraldéhyde et le butanol.
- Carburant et additifs pour carburant : Utilisé comme carburant ou additif pour carburant en raison de son indice d’octane élevé et de ses propriétés de combustion propre.
- Réfrigérants : Utilisé comme réfrigérant en raison de son faible point d’ébullition et de sa nature ininflammable.
- Adhésifs : Utilisés dans la production d’adhésifs thermofusibles. Ceux-ci sont couramment utilisés dans l’industrie de l’emballage.
- Caoutchouc et plastiques : Utilisé comme matière première pour la production de caoutchouc synthétique et de plastiques, tels que le polybutène.
- Lubrifiants : Utilisé comme additif lubrifiant pour améliorer les propriétés lubrifiantes et anti-usure des lubrifiants.
- Industrie pharmaceutique : Utilisé comme matière première dans la synthèse de divers produits pharmaceutiques.
Des questions:
Q : Pourquoi pourrait-il être difficile de visualiser la séparation du cis- et du trans-2-butène par CCM ?
R : Il peut être difficile de visualiser la séparation du cis- et du trans-2-butène par CCM car ces isomères ont des propriétés physiques et chimiques très similaires. Cela peut entraîner des points qui se chevauchent sur la plaque CCM, ce qui rend difficile la distinction entre les deux isomères.
Q : Quelle est la masse molaire du 1-butène si 5,38 × 1016 molécules de 1-butène pèsent 5,00 μg ?
R : La masse molaire du but-1-ène peut être calculée en utilisant le nombre de molécules donné et le poids de l’échantillon. La masse molaire du but-1-ène est de 56,11 g/mol.
Q : Votre tâche consiste à convertir le 2-bromobutane en 1-butène avec le rendement le plus élevé. Quels réactifs utiliseriez-vous ?
R : Une méthode possible pour convertir le 2-bromobutane en but-1-ène consiste à effectuer une réaction d’élimination de l’E2 en utilisant une base forte, telle que le tert-butoxyde de potassium (KOtBu), dans un solvant aprotique polaire, tel que le diméthylsulfoxyde (DMSO). ou le tétrahydrofurane (THF).
Q : Comment fabriquer du 1-butène ?
R : le but-1-ène peut être fabriqué par diverses méthodes, telles que la déshydrogénation catalytique des butènes, la dimérisation sélective de l’éthylène suivie d’une déshydratation ou la réaction de métathèse entre le propylène et l’éthylène. Ces méthodes impliquent différents catalyseurs et conditions de réaction, et une attention particulière doit être accordée pour garantir un rendement et une pureté élevés du produit final.
