Le 1-Butanol (C4H9OH) est un alcool incolore à l’odeur légèrement sucrée. Il est utilisé comme solvant, en synthèse organique et comme source de carburant. Il peut également être utilisé dans les produits cosmétiques et de soins personnels.
| Nom UICPA | Butane-1-ol |
| Formule moléculaire | C4H10O |
| Numero CAS | 71-36-3 |
| Synonymes | Alcool n-butylique, butanol, alcool butylique, alcool 1-butylique, 1-butanol, butanolène, hydrate de butylène, hydrate de butyle |
| InChI | InChI=1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
Propriétés du 1-butanol
Formule 1-Butanol
La formule moléculaire du 1-Butanol est C4H10O. Cela signifie qu’il contient quatre atomes de carbone, dix atomes d’hydrogène et un atome d’oxygène. Il a une structure linéaire, avec le groupe hydroxyle (-OH) attaché au premier atome de carbone.
1-Butanol Masse molaire
La masse molaire de C4H9OH est de 74,12 g/mol. Cela signifie qu’une mole de C4H9OH pèse 74,12 grammes. La masse molaire est une propriété importante d’une substance car elle aide à déterminer la quantité de substance présente dans un échantillon donné.
Point d’ébullition du 1-butanol
C4H9OH a un point d’ébullition de 117,7 °C (243,9 °F). Cela signifie qu’il passera de l’état liquide à l’état gazeux à cette température. Le point d’ébullition du C4H9OH est supérieur à celui de l’éthanol en raison de la présence d’un atome de carbone supplémentaire.
1-Butanol Point de fusion
Le point de fusion du C4H9OH est de -90,6 °C (-131,1 °F). Cela signifie qu’il passera de l’état solide à l’état liquide à cette température. Le point de fusion du C4H9OH est inférieur à celui de l’acide butanoïque, qui a un poids moléculaire similaire.
1-Butanol Densité g/ml
La densité du C4H9OH est de 0,81 g/mL. Cela signifie qu’un millilitre de C4H9OH pèse 0,81 gramme. La densité du C4H9OH est inférieure à celle de l’eau, qui a une densité de 1 g/mL.
1-Butanol Poids moléculaire
Le poids moléculaire du C4H9OH est de 74,12 g/mol. C’est la somme des poids atomiques de tous les atomes de sa formule moléculaire. Le poids moléculaire est une propriété importante d’une substance car il aide à déterminer ses propriétés physiques et chimiques.
Structure du 1-butanol
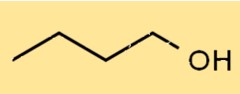
La structure du C4H9OH est un alcool à chaîne droite, avec le groupe hydroxyle (-OH) attaché au premier atome de carbone. Il a une structure linéaire, avec quatre atomes de carbone, dix atomes d’hydrogène et un atome d’oxygène. Sa structure lui permet de former des liaisons hydrogène avec d’autres molécules.
Solubilité du 1-butanol
C4H9OH est soluble dans l’eau et les solvants organiques. Sa solubilité dans l’eau diminue à mesure que la température augmente. Il est également soluble dans les solvants polaires, tels que l’éthanol et le méthanol. La solubilité du C4H9OH dans les solvants organiques, tels que le benzène et l’éther, est plus élevée que dans l’eau. Cela le rend utile comme solvant en synthèse organique.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,810 g/mL à 25 °C |
| Couleur | Incolore |
| Odeur | Légèrement sucré |
| Masse molaire | 74,12 g/mole |
| Densité | 0,81 g/ml |
| Point de fusion | -90,6 °C (-131,1 °F) |
| Point d’ébullition | 117,7 °C (243,9 °F) |
| Point d’éclair | 35 °C (95 °F) |
| Solubilité dans l’eau | 79 g/L à 20 °C |
| Solubilité | Soluble dans l’éthanol, l’éther diéthylique, l’acétone, le benzène, le chloroforme |
| Pression de vapeur | 1,16 kPa à 20 °C |
| Densité de vapeur | 2,55 (par rapport à l’air) |
| pKa | 16.06 |
| pH | Neutre (7) |
1-Sécurité et dangers du butanol
Le C4H9OH présente plusieurs risques pour la sécurité, ce qui rend crucial sa manipulation avec précaution. C’est un liquide inflammable qui peut facilement s’enflammer lorsqu’il est exposé à la chaleur ou à des étincelles. Il émet également des vapeurs nocives qui peuvent provoquer des irritations et des dommages aux yeux, au système respiratoire et à la peau. Lorsqu’il est ingéré, il peut provoquer de graves problèmes de santé, notamment des étourdissements, de la confusion et même le coma. Il est donc essentiel de porter des équipements de protection tels que des gants, des lunettes et des respirateurs lors de la manipulation du C4H9OH. En cas de contact avec la peau ou les yeux, rincer à l’eau et consulter immédiatement un médecin. Un stockage, une manipulation et une élimination appropriés du C4H9OH sont nécessaires pour prévenir les accidents et garantir la sécurité.
| Symboles de danger | F, Xi |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Porter des gants de protection/un équipement de protection des yeux/du visage. EN CAS DE CONTACT AVEC LA PEAU (ou les cheveux) : Enlever immédiatement tous les vêtements contaminés. Rincer la peau à l’eau/douche. EN CAS DE CONTACT AVEC LES YEUX : Rincer avec précaution à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si elles sont présentes et faciles à faire. Continuez à rincer. Conserver dans un endroit frais, sec et bien ventilé, à l’écart des substances incompatibles. |
| Numéros d’identification de l’ONU | ONU 1120 |
| Code SH | 2905.16.00 |
| Classe de danger | 3 |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) 2,46 g/kg ; CL50 (inhalation, rat) 37 800 ppm/4h |
Méthodes de synthèse du 1-butanol
On peut synthétiser le C4H9OH par plusieurs méthodes, notamment la réduction du butyraldéhyde, la réalisation du processus oxo ou la fermentation.
La fermentation est une méthode courante pour produire du C4H9OH à partir de la biomasse. Dans le processus de fermentation, des micro-organismes comme Clostridium acetobutylicum sont responsables de la production d’un mélange d’acides organiques et d’alcools, dont C4H9OH, en fermentant des sucres, des amidons ou de la cellulose.
Le procédé oxo, également connu sous le nom d’hydroformylation, implique la réaction du propène avec du monoxyde de carbone et de l’hydrogène en présence d’un catalyseur tel que le cobalt ou le rhodium. L’hydrogénation du butyraldéhyde produit du C4H9OH. Lorsque le butyraldéhyde subit une hydrogénation, il forme le composé C4H9OH.
Une autre méthode de synthèse du C4H9OH consiste à réduire le butyraldéhyde avec de l’hydrogène en présence d’un catalyseur tel que le palladium ou le nickel. Cette réaction produit du C4H9OH avec de l’eau comme sous-produit.
Le procédé Fischer-Tropsch est une méthode de production de C4H9OH à partir de combustibles fossiles. Il s’agit d’utiliser un catalyseur pour faire réagir le monoxyde de carbone et l’hydrogène, ce qui entraîne la production de divers hydrocarbures, dont C4H9OH.
Utilisations du 1-butanol
Le C4H9OH a de nombreuses utilisations dans diverses industries en raison de ses propriétés uniques. Certaines utilisations courantes du C4H9OH comprennent :
- Solvant : utilisé comme solvant pour diverses substances, notamment les résines, les graisses, les huiles et les cires.
- Intermédiaire : utilisé comme intermédiaire dans la production d’autres produits chimiques, tels que l’acrylate de butyle et l’acétate de butyle.
- Additif : Utilisé comme additif dans l’essence et les carburants diesel pour augmenter leur indice d’octane et réduire les émissions.
- Extractant : utilisé comme extractant dans la production d’antibiotiques, de vitamines et d’hormones.
- Produits cosmétiques et de soins personnels : utilisés dans la production de divers produits cosmétiques et de soins personnels, notamment des lotions, des crèmes et des parfums.
- Arômes et parfums : Utilisé comme exhausteur de goût et de parfum dans l’industrie alimentaire et des boissons.
- Produits pharmaceutiques : utilisés dans la production de divers produits pharmaceutiques, notamment des sédatifs et des hypnotiques.
- Pesticides : Utilisés comme composant dans la production de divers pesticides et herbicides.
Des questions:
Q : Le butanol est-il polaire ?
R : Oui, le butanol est polaire en raison de la présence du groupe hydroxyle (-OH) qui lui confère un moment dipolaire.
Q : Le 1-butanol est-il soluble dans l’eau ?
R : Oui, C4H9OH est partiellement soluble dans l’eau en raison de la présence du groupe hydroxyle qui lui permet de former des liaisons hydrogène avec les molécules d’eau.
Q : Le 1-butanol a-t-il une liaison hydrogène ?
R : Oui, C4H9OH a une liaison hydrogène en raison de la présence du groupe hydroxyle (-OH) qui peut former des liaisons hydrogène avec d’autres molécules C4H9OH ou avec des molécules d’eau.
Q : Combien de ml de 1-butanol sont nécessaires pour préparer 725 ml d’une solution aqueuse à 0,350 m de ce soluté ?
R : Le calcul nécessite la masse molaire de C4H9OH, qui est de 74,12 g/mol. Pour préparer une solution 0,350 M de C4H9OH, 26,12 g de C4H9OH sont nécessaires. En utilisant la formule : moles = concentration x volume, nous pouvons calculer le volume de C4H9OH nécessaire comme suit : volume = moles / concentration. Ainsi, le volume de C4H9OH nécessaire pour préparer 725 ml d’une solution 0,350 m est de (26,12/0,350) = 74,6 ml.
Q : Quel alcool se comportera le plus comme l’eau ? c2h5oh c4h9oh c10h21oh c7h15oh
R : Parmi les options proposées, l’éthanol (C2H5OH) se comportera le plus comme l’eau en raison de sa petite taille moléculaire et de la présence du groupe hydroxyle (-OH), qui lui permet de former de fortes liaisons hydrogène avec les molécules d’eau.
Q : Quels sont les produits de l’équation équilibrée pour la combustion de c4h9oh ?
R : L’équation équilibrée pour la combustion du C4H9OH est : C4H9OH + 6O2 → 4CO2 + 5H2O. Les produits de la réaction sont le dioxyde de carbone (CO2) et l’eau (H2O).
Q : Quelle est la masse molaire du butanol (c4h9oh) ?
R : La masse molaire du butanol (C4H9OH) est de 74,12 g/mol.
Q : C4h9oh a-t-il une liaison hydrogène ?
R : Oui, le C4H9OH possède une liaison hydrogène en raison de la présence du groupe hydroxyle (-OH) qui lui permet de former des liaisons hydrogène avec d’autres molécules de C4H9OH ou avec des molécules d’eau.
Q : Combien de grammes d’alcool butylique (c4h9oh) y a-t-il dans une solution de 2 500 ml, soit 2,22 m ?
R : Pour calculer le nombre de grammes d’alcool butylique dans la solution, nous devons utiliser la formule : moles = concentration x volume. La concentration de la solution est de 2,22 moles/L et le volume est de 2,5 L (2 500 ml convertis en L). Ainsi, le nombre de moles d’alcool butylique dans la solution est : 2,22 x 2,5 = 5,55 moles. Pour calculer la masse d’alcool butylique, il faut multiplier le nombre de moles par sa masse molaire (74,12 g/mol) : 5,55 x 74,12 = 411,4 g. Il y a donc 411,4 grammes d’alcool butylique dans une solution de 2 500 ml, soit 2,22 M.
